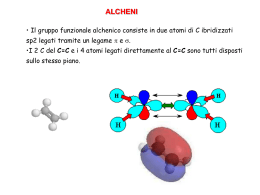
CHIMICA ORGANICA La chimica organica è la chimica dei composti del CARBONIO La teoria base della chimica organica è la teoria strutturale: 1) Gli atomi dei composti organici possono formare un numero definito di legami. (Valenza) C O 2) L’atomo di carbonio si può legare mediante una o più valenze ad altri atomi di carbonio C C C C C C C ISOMERI: composti differenti che hanno la stessa formula molecolare ISOMERIA Isomeri di struttura: sono quei composti che hanno la stessa formula molecolare, ma differiscono nell’ordine con cui gli atomi sono legati. CH3CH2OH CH3OCH3 I legami chimici possono essere: Si forma a seguito del trasferimento di uno o ionico o elettrovalente più elettroni da un atomo all’altro Si forma quando due atomi accoppiano i loro covalente elettroni dispari. Principio dell’Aufbau: gli orbitali sono riempiti con gli elettroni secondo un ordine crescente di energia Principio di esclusione di Pauli: ogni orbitale può contenere fino ad un massimo di due elettroni, purchè i loro spin siano di segno opposto. Regola di Hund: gli elettroni si dispongono sugli orbitali degeneri in modo da raggiungere il maggior numero possibile di elettroni dispari Orbitali σΠ Alcani Alcani: CnH2n+2 Formula generale: Cicloalcani: CnH2n Nomenclatura degli alcani •La posizione dei sostituenti è specificata numerando la catena più lunga in modo essi abbiano il numero più piccolo 1 CH3 6 2 CH2 5 3 CH2 4 2 1 Numerazione corretta 6 Numerazione non corretta CH3 CH2 CH3 CH2 CH3 4 5 3-etilesano •Quando sono presenti diversi sostituenti vanno elencati in ordine alfabetico usando i prefissi di-, tri-, etc. per indicare la presenza di sostituenti uguali CH3- CH3CH2- metile CH3CH2CH2CH2- CH3CH2CH2- propile Carbonio secondario Gruppo isopropilico H3C C CH H2 sec-butile CH3 H3C C CH3 terz-butile CH3 H3 C CH CH3CH2CH2CH3 Isomeri di struttura butile Carbonio terziario CH3 CH3 H3C CH etile CH3 Alcani: isomeri di struttura Per n>3 esistono più isomeri di struttura. Le diverse strutture di queste molecole portano a differenti proprietà chimiche e fisiche Modello ball and sticks n-butano isobutano CH3 CH2 CH2 Modello space filling CH3 CH3 CH CH3 CH3 Gli alcani a catena lineare sono chiamati normali (n-). Gli altri sono detti ramificati Cicloalcani: nomenclatura La nomenclatura segue le stesse regole adottate per gli alcani. Si premette il prefisso ciclo- e l’anello viene numerato in modo da avere i numeri più bassi per i sostituenti. CH2 CH3 6 5 1 4 2 3 CH3 1-etil-3-metilcicloesano Cicloalcani Oltre a formare catene, gli atomi di C possono formare degli anelli. I cicloalcani sono anelli formati esclusivamente da gruppi CH2 Formula generale dei cicloalcani: CnH2n Il più semplice è il ciclopropano C3H6 in cui gli atomi di C formano un triangolo equilatero con angoli di 60°; gli orbitali ibridi sp3 non si sovrappongono estesamente e ciò provoca un legame C-C debole ed in tensione e la molecola è molto più reattiva del propano. Analogamente si comporta il ciclobutano (angoli di 90°). Al contrario il cicloepentano e il cicloesano sono abbastanza stabili perché i loro anelli hanno angoli di legame più vicini all’angolo del tetraedro. C C (n > 3) C Cicloesano: Stereochimica Cicloesano: Stereochimica Cicloesano: Stereochimica Cicloesano: Stereochimica Alcani: Sintesi Il petrolio rappresenta la fonte principale di idrocarburi saturi, i quali servono fondamentalmente per la produzione di energia mediante la combustione H H C C + 2 R-X + Zn + 2H+ R-X + R’-X H2 Pt, Ni Solvente C C 2R-H + ZnX2 R-R’ Omolisi A. + B. A:- + B+ A:B Eterolisi A+ + :B- Radicale carbonio C: Z C. + Z. C+ + :Z - Carbocatione C: Z C: - + Z + Carbanione Alcani: reazioni H H C H Cl + NaOH H C H OH + NaCl H C H Cl2 calore 2Cl. + Cl2 C Cl + HCl Stadio di inizio luce CH4 + Cl. HCl + CH3. CH3. + Cl2 CH3Cl + Cl. Stadi di propagazione Stadi di terminazione H H H C + .C H H H H H H C C H H H H H H C + Cl H C Cl H H Cl + Cl Cl Cl Definizione di isomero Si definiscono isomeri due o più molecole aventi stessa formula molecolare ma differente formula di struttura. Esistono vari tipi di isomeria: Strutturale: gli atomi di carbonio sono legati tra di loro in maniera differente (per esempio isobutano e normalbutano). Stereoisomeria: gli stereoisomeri presentano gli stessi legami ma differiscono per il modo in cui gli atomi sono orientati nello spazio. Per trasformare uno stereoisomero nell’altro è necessario rompere e riformare almeno un legame. Si chiamano diastereoisomeri gli stereoisomeri che non sono uno l’immagine speculare dell’altro. Si chiamano isomeri geometrici i diastereoisomeri che debbono la loro esistenza alla mancanza di libera rotazione intorno ai doppi legami (isomeria cis/trans nel 2-butene). Si chiamano isomeri ottici gli isomeri che non sono sovrapponibili alla loro immagine speculare. Si chiamano isomeri conformazionali gli isomeri che possono trasformarsi l’uno nell’altro senza la rottura di legami (per esempio le diverse conformazioni anti e gauche del n-butano). La sistemazione degli atomi che caratterizza un dato stereoisomero si chiama la sua configurazione Attività ottica La luce polarizzata è una luce le cui vibrazioni avvengono soltanto in uno degli infiniti piani possibili Una sostanza otticamente attiva ruota il piano della luce polarizzata. Gli enantiomeri hanno punti di fusione, ebollizione ed indici di rifrazione assolutamente identici. Gli enantiomeri differiscono solo nelle interazioni con sostanze chirali o con fenomeni fisici di natura chirale. I diastereoisomeri hanno proprietà chimiche simili, ma proprietà fisiche differenti Racemo: miscela in parte uguali di due enantiomeri Una molecola chirale è una molecola non sovrapponibile alla propria immagine speculare. Si chiama centro chirale un atomo di carbonio al quale sono legati quattro gruppi diversi. Un composto meso è un composto le cui molecole sono sovrapponibili alla loro immagine speculare sebbene contengano dei centri chirali Reazioni di Sostituzione Nucleofila Nu:- + nucleofilo OH- R--X R Nu substrato prodotto + H3C Cl + H3C OH δ+ δ- C X Xgruppo uscente + Cl Sostituzione nucleofila SN2 E’ una reazione bimolecolare V = k [Nu:-] [R-X] Avviene con substrati primari o secondari Avviene in un unico step con inversione di configurazione Sostituzione nucleofila SN1 E’ una reazione unimolecolare V = k [R-X] Avviene con substrati terziari Avviene in due step con inversione di configurazione più parziale racemizzazione Carbocatione Un sistema elettricamente carico è tanto più stabilizzato quanto più la carica è dispersa o delocalizzata. R R + R C R H + + H + > R C > R C > H C H H H CONFRONTO FRA: SN2 SN1 Cinetica del secondo ordine Cinetica del primo ordine Completa inversione stereochimica Racemizzazione Assenza di trasposizioni Trasposizioni V = k [Sub] [Nu:-] La reazione SN2 è favorita da solventi che stabilizzano meno il nucleofilo anionico: solventi aprotici o solventi a bassa polarità. V = k [Sub] La reazione SN1 è favorita da solventi a elevato potere ionizzante, cioè da solventi polari protici, che facilitano l’espulsione del gruppo uscente. Reazioni di eliminazione Le reazioni di eliminazione sono caratterizzate dalla rimozione in una molecola di due gruppi, che possono essere situati: a. sullo stesso atomo di carbonio (α-eliminazione) b. su atomi di carbonio adiacenti (β-eliminazione o eliminazione 1,2) con formazione di un legame multiplo CH3CH CH3 Br C2H5ONa C2H5OH H2C CH CH3 + NaBr + C2H5OH deidroalogenzioni CH3 CH3C Br CH3 C2H5ONa C2 H5 OH H2C C CH3 CH3 + NaBr + C2 H5 OH Reazione di eliminazione E2 E’ una reazione bimolecolare V = k [R-X] [:B-] Avviene in un unico step Avviene con substrati primari o secondari Reazione di eliminazione E1 E’ una reazione unimolecolare V = k [R-X] Avviene con substrati terziari Mostrano lo stesso effetto della struttura sulla reattività osservato nelle reazioni SN1 Danno luogo a trasposizioni Nella deidroalogenazione il prodotto preferito è alchene che ha il maggior numero di gruppi alchilici legati agli atomi di carbonio impegnati nel doppio legame (Saytzeff) L’eliminazione secondo E1 mostra un forte orientamento secondo Saytzeff, cioè quando si può formare più di un alchene, il prodotto preferito è l’alchene più ramificato. Competizione tra sostituzione ed eliminazione SN2 verso E2: Quando la sostituzione e l’eliminazione bimolecolari sono reazioni competitive, la quantità del prodotto di eliminazione aumenta passando da un alogenuro alchilico primario, al secondario e poi al terziario SN2 E2 Un solvente meno polare e una temperatura più elevata favoriscono l’E2. CH3 L’uso di una base stericamente impedita CH3C O favorisce l’E2 CH3 Competizione tra sostituzione ed eliminazione SN1 verso E1: L’eliminazione E1 e la sotituzione SN1 procedono con formazione dello stesso intermedio: l’eterolisi per formare il carbocatione Nucleofili deboli e l’uso di solventi polari favoriscono l’E1. Nonostante sia difficile influenzare la distribuzione relativa dei prodotti SN1 e E1 si riscontra che le reazioni SN1 sono favorite da una bassa temperatura. In generale le reazioni di sostituzione degli alogenuri terziari non hanno un grande interesse preparativo, in quanto danno troppo facilmente l’eliminazione Alcheni Formula Generale: CnH2n Gli alcheni rappresentano una classe di idrocarburi insaturi. Il doppio legame rappresenta il gruppo funzionale caratteristico degli alcheni Alcheni: nomenclatura H2C CH CH2CH3 CH3C CH CH2CH2CH3 H 1-butene 2-esene La catena è numerata a partire dall’estremità che è più vicina al doppio legame 1 2 3,5 dimetil cicloesene CH3 CH3 Nel caso di cicloalcheni sostituiti, gli atomi di carbonio dell’anello sono numerati in modo che i carboni del doppio legame portino i numeri 1 e 2. H2C CH H2C CH CH2 Gruppo vinile Gruppo allile I gruppi vinilico e allilico sono due sostituenti alchenilici e possono determinare il nome di alcune olefine Alcheni: isomeria cis/trans Attorno agli atomi di C uniti mediante il doppio legame la rotazione è impedita. Ciò comporta il manifestarsi dell’isomeria geometrica. Ad esempio il 2-butene esiste in due isomeri geometrici. Cis 2-butene H H C=C C=C CH3 CH3 H CH3 CH3 H Trans 2-butene Alcheni: stereochimica C C + H H Pt C C ΔH = 30 Kcal/mole H H L’idrogenazione di un alchene è una reazione esotermica e la maggior parte degli alcheni hanno calore di idrogenazione di circa 30 kcal/mole. Nella coppia cis-trans di due alcheni stereoisomeri, l’isomero trans è sempre L’isomero cis è il meno stabile a causa delle maggiori tensioni steriche più stabile dell’isomero cis. Idrocarburi insaturi: alcheni Orbitali molecolari dell’etilene Negli alcheni i carboni dei doppi legami presentano ibridazione sp2. Il legame C-C è formato per accoppiamento di due elettroni presenti negli orbitali sp2 e il legame per accoppiamento di elettroni p. I due orbitali p sui due atomi di carbonio dell’etilene devono essere allineati (paralleli) per poter formare legami . Questo impedisce la rotazione dei due gruppi CH2 l’uno rispetto all’altro a temperatura ordinaria, contrariamente agli alcani per i quali è possibile la libera rotazione. Alcheni: preparazione Il metodo più generale per la preparazione degli alcheni si basa sulle reazioni di eliminazione + H calore C C C C H OH La facilità con cui gli alcooli eliminano acqua in ambiente acido diminuisce nel seguente ordine: R R R C OH R > R C OH H H > R C OH H La deitrazione degli alcooli segue la regola di Saytsev: i prodotti principali sono gli alcheni più stabili. Alcheni: preparazione La deidratazione degli alcooli è una reazione E1 a carico dell’alcool Alcuni alcooli primari e secondari subiscono una modificazione del loro protonato. scheletro di atomi di carbonio (trasposizioni) CH3 CH3 H + CH3CH3CCHCCHO3 H + H O H3 C OHCH3 H H3 C H + H3 C C O H CH3 CH3CH3 H3C H CH3CH3 + C C + O HHC + CH3C C H3CH C H CH 2 OCH3 3 2 CH3 80% 20% CH3 + H3 C C H + O H CH3 H H C H + H3 C C CH3 H + O H CH2 H3 C C CH3 H + + H O H Alcheni: reazioni Per il fatto di possedere un doppio legame carbonio-carbonio, gli alcheni sono molto reattivi e danno reazioni tipiche di addizione, che portano alla formazione di composti saturi. La reazione tipica degli alcheni è l'addizione elettrofila, l'addizione cioè di reagenti acidi. La reazione di addizione al doppio legame è un esempio di reazione che procede con rottura eterolitica del legame. Le reazioni di addizione tipiche degli alcheni sono: Addizione di alogeni Addizione di acidi alogenidrici Addizione di acqua o idratazione Alcheni: reazioni Meccanismo dell’addizione elettrofila Gli alcheni reagiscono immediatamente con il bromo a temperatura ambiente ed in assenza di luce. L'atomo di alogeno reso parzialmente positivo diviene un reattivo elettrofilo (un acido di Lewis) ed è fortemente attratto dal doppio legame. Si formano uno ione bromonio ciclico intermedio e un alogenione negativo. L'esistenza di un effettivo catione intermedio parrebbe confermata dal fatto che questa reazione dà sempre l'addizione trans (è cioè stereospecifica). L’apertura dell’anello a tre termini è una reazione SN2 Alcheni: reazioni Nel caso dell'addizione ad un termine superiore all'etene, contenente quindi almeno un radicale alchilico, l'alchene possiede già una polarizzazione, dovuta all'effetto induttivo, elettrondonatore (elettron-respingente), del radicale alchilico: Così, dalla reazione: Nell'addizione di un acido ad un doppio legame carbonio-carbonio, l'idrogeno si lega al carbonio che ha già il maggior numero di idrogeni legati a sé. (Regola di Markovnikov) La regola di Markovnikov può essere così generalizzata: "L'addizione elettrofila ad un doppio legame carbonio-carbonio implica la formazione intermedia del carbocatione più stabile e cioè dell'ordine maggiore possibile." Alcheni: stereochimica I termini cis e trans per distinguere due alcheni diastereoisomeri si applicano senza ambiguità solamente agli alcheni con due sostituenti Nel caso di alcheni con quattro sostituenti diversi legati ai carboni insaturi si ha: Cl F C C C H Z H C C Cl C Br Cl F Cl Br (E)-1-Bromo-1,2-dicloroetene H Br E Cl C C Br H Cl (Z)-1-Bromo-1,2-dicloroetene Alchini Formula Generale: CnH2n-2 Desinenza finale: …..ino Alchini: reazioni La chimica degli alchini è la chimica del triplo legame; gli alchini danno reazione di addizione elettrofila come gli alcheni. C C HCl H HCl C C Cl H Cl C C H Cl Cloroalchene Dicloruro geminale Gli idrogeni dell’acetilene sono notevolmente più acidi sia di quelli dell’etilene che dell’etano H H C C H Ka ~ H C C H 10-25 H H H C C H H H H Ka ~ 10-44 Ka ~ 10-50 L’acetiluro di sodio e gli altri alchilacetiluri possono essere preparati trattando gli alchini terminali con sodioammide in ammoniaca liquida. H C C H + NaNH2 H C C Na + + NH3 Dieni I dieni sono semplicemente alcheni che contengono due doppi legami. I dieni possono essere classificati in: Coniugati, quando i doppi legami sono separati da un solo legame semplice. Isolati, quando i doppi legami sono separati da più di un legame semplice. Cumulati (o alleni), quando i doppi legami non sono separati l'uno dall'altro. Dieni coniugati Il primo termine di questa serie è l'1,3-butadiene ed è il diene più importante; viene usato industrialmente per fabbricare la gomma sintetica. Dieni coniugati Il sistema di doppi legami dei dieni coniugati è termodinamicamente più stabile sia del doppio legame degli alcheni sia del sistema di doppi legami dei dieni isolati. Concludiamo perciò che i due doppi legami coniugati dell’1,3 butadiene sono più stabili di due doppi legami dell’1-butene. Dieni coniugati: risonanza Secondo la teoria della risonanza, una molecola può essere rappresentata da tutte le possibili strutture che differiscano esclusivamente per la disposizione degli elettroni. Di queste strutture (strutture canoniche di risonanza), nessuna rappresenta realmente la molecola che è piuttosto un ibrido di risonanza di tutte le strutture possibili. Per il butadiene si possono scrivere le seguenti formule risonanti, a cariche separate: Dieni coniugati: risonanza È quindi possibile immaginare una delocalizzazione degli elettroni coinvolga l'intero gruppo funzionale del diene coniugato. che ed equivale alla risonanza che contribuirebbe a stabilizzare la molecola del diene coniugato. Dieni coniugati: reattività I dieni coniugati non solo mostrano una stabilità termodinamica maggiore di quella prevedibile teoricamente, ma mostrano anche un comportamento particolare nelle loro reazioni con reagenti elettrofili. È evidente che un anione, o una qualsiasi base, potrà attaccarsi o in posizione 2 o in posizione 4: la "direzione" dell' attacco può essere controllata scegliendo adeguatamente le condizioni di reazione. Le quantità relative dei prodotti di addizioni 1,2 e 1,4 non sono costanti ma dipendono dalla temperatura a cui si effettua la reazione. Dieni coniugati Un importante diene coniugato è l'isoprene (2-metil-1,3-butadiene) che è il termine successivo della serie. La gomma naturale (cis-poliisoprene) è un polimero di questa molecola. I terpeni (componenti degli oli essenziali di molte piante), ad esempio, contengono un determinato numero di unità isopreniche unite fra loro in modo regolare, secondo il sistema testa-coda (regola isoprenica). CH2 C CH3 CH3 CH2 C CH2 C H H C CH2 C CH2 CH3 C CH2 H Idrocarburi aromatici: benzene Il benzene è il capostipite di una vasta classe di composti organici, i composti aromatici. H H H H H H H H H H H H Struttura di Kekulè del benzene Idrocarburi aromatici: benzene Tutti i legami carbonio - carbonio nel benzene sono equivalenti ed hanno una lunghezza (ed una energia) intermedia tra quella di un legame semplice e quella di un legame doppio (~1.39 Å). Ogni atomo di carbonio ha ibridazione sp2 e quindi una struttura planare triangolare con angoli di legame di 120°. La molecola può essere rappresentata con una nuvola elettronica estesa sopra e sotto al piano individuato dagli atomi di carbonio. Benzene: aromaticità Basandosi su calcoli applicati alla meccanica quantistica, Erich Hückel dimostrò che per essere aromatico un composto deve avere nuvole elettroniche cicliche contenenti 4n+2 elettroni delocalizzati (regola di Hückel). La delocalizzazione non è quindi condizione sufficiente per l'aromaticità, ma occorre un determinato numero (2, 6, 10, 14, etc.) di elettroni . base forte H H Cicloottatetraene H Naftalene Annuleni: composti monociclici caratterizzati da un’alternanza di legami semplici e doppi. Benzene: reazioni L’anello del benzene, nelle sue reazioni più tipiche, si comporta come una fonte di elettroni, cioè come una base Le reazioni tipiche dell’anello benzenico sono le reazioni di sotituzione elettrofila. H E 1. Il sostituente elettrofilo si avvicina all'anello lateralmente rispetto al piano della molecola. H sugli elettroni del benzene H H H e uno dei legami 2. Si ha una azione di richiamo si polarizza in + modo da consentire + E+ + H 3. l'attacco del H sostituente, H che sfrutta una coppia di elettroni H per legarsi. H 4 - 6. Si forma un intermedio instabile, detto complesso , al quale H H contribuiscono tre differenti forme risonanti (4,5,6). L'atomo che ha subito l'attacco ha cambiato il suo stato di ibridazione da sp2 a sp3, per cui esso è escluso dalla "coniugazione" col resto del sistema. Anche se si può ancora parlare di risonanza , non si può più parlare di aromaticità. 7. L'energia di risonanza di questo catione non è elevata come quella del benzene; l'espulsione di un protone può tuttavia riportare il complesso s alle condizioni di aromaticità. 8. Si ottiene così il prodotto sostituito finale. Benzene: sostituenti Quando un elettrofilo attacca l'anello aromatico, è il gruppo già legato che assume il controllo cinetico della reazione e stabilisce il punto d'attacco del nuovo sostituente. I gruppi sostituenti si possono classificare in: rendono il derivato più Attivanti: reattivo del benzene: sono capaci di "rifornire" di elettroni l'anello (elettrondonatori). rendono il compostoDisattivanti: meno reattivo del benzene: impoveriscono di elettroni l'anello (elettronattrattori). Per quanto riguarda invece l'orientamento di un secondo sostituente, i gruppi si CH possono distinguere in orto-para orientanti e meta orientanti. 3 orto orto CH3 Toluene NH2 meta Anilina para OH Fenolo COOH Cl metaClorobenzene Acido benzoico Benzene: sostituenti: attivanti e disattivanti Per stabilire se un gruppo sia attivante o disattivante, occorre considerare due diversi effetti che esso può produrre sull'anello: L' Effetto induttivo L' Effetto mesomero o di risonanza Effetto induttivo Dipende dalla differenza di elettronegatività fra il carbonio e l'elemento ad esso legato. Esso spiega perché gli alogeni siano dei disattivanti: essendo molto elettronegativi, sono elettronattrattori e quindi impoveriscono di elettroni l'anello.Spiega anche perché i gruppi NO2, -CN, -SO3-, -COOH siano ugualmente disattivanti Effetto elettronattrattore del gruppo nitrile sull'anello benzenico Benzene: sostituenti: attivanti e disattivanti Effetto mesomero Alcuni sostituenti (-NH2, -OH, ecc.) sono attivanti, pur contenendo atomi elettronegativi (e quindi con un effetto induttivo elettronattrattore). Ciò significa che questi gruppi "devono" rifornire di elettroni l'anello a causa di un effetto diverso da quello induttivo: questo effetto è dovuto al fenomeno della risonanza. Strutture risonanti dell'anilina: le posizioni orto e para sono arricchite di elettroni Nel caso di sostituenti come -NO2, -CN, ecc., l'effetto mesomero ha una "direzione" opposta. All'effetto induttivo elettronattrattore si aggiunge l'effetto mesomero ugualmente elettronattrattore. Per questo motivo i gruppi -NO2 e -CN sono forti disattivanti. Benzene: sostituenti: attivanti e disattivanti Nel caso degli alogeni la situazione è analoga a quella di un gruppo come -NH2 o -OH, cioè l'effetto mesomero è elettrondonatore, come si può vedere dalle strutture risonanti del clorobenzene. Ma poiché in questo caso l'effetto induttivo è preponderante, un alogeno è un disattivante dell'anello, ma è orto-para orientante. Strutture risonanti del clorobenzene: caso analogo all'anilina Un gruppo alchenilico ha un effetto elettrondonatore e quindi attivante dell'anello. In questo caso tuttavia non è coinvolto il fenomeno dell'iperconiugazione, ma l'effetto mesomero del doppio legame stesso: Benzene: sostituenti: conclusioni Tutti i gruppi sostituenti (attivanti o disattivanti) esercitano la loro influenza massimamente sulle posizioni orto e para. Un gruppo attivante attiva tutte le posizioni, ma attiva le orto e para molto più della meta; un gruppo disattivante disattiva tutte le posizioni, ma disattiva le orto e le para molto più delle meta. Inoltre: un gruppo può respingere o attirare elettroni per effetto induttivo, per effetto mesomero, o per entrambi. Questi effetti hanno direzione opposta solo per i gruppi -NH2, -OH, ecc. e per gli alogeni. Per i primi è preponderante l'effetto mesomero, per gli alogeni quello induttivo. Per questo motivo gli alogeni hanno un comportamento "anomalo", essendo disattivanti, ma orto-para orientanti. Composti aromatici eterociclici N Pyridine N O H Furan S Thiophene Pyrrole + N N N- O + O - + O + N- + N - + O - + O Alcooli Alcooli: proprietà fisiche C C C C C C C C H H OH2+ H OH + Ossido-Riduzione in chimica organica In chimica organica si dice che la riduzione corrisponde ad un aumento del contenuto di idrogeno di una molecola, oppure ad una diminuizione del suo contenuto in ossigeno. O R C OH rid O Il contenuto R C Hdi ossigeno diminuisce O Il contenuto di idrogeno aumenta RCH OH R C H 2 L’ossidazione di una molecola è una reazione che avviene con cessione di elettroni e quindi con aumento dello stato di ossidazione di un atomo. Essa corrisponde ad un aumento del contenuto di ossigeno della molecola oppure ad una diminuizione del contenuto di idrogeno. O RCH3 RCH2 OH R C H O R C OH Alcooli: ossidazione e riduzione O O RCH2OH R C OH R C H O O R RCH2OH RCH2OH C OR' C R' R R CH R' OH O RCH2OH R C H O R C OH O R CH R' R C R' R OH R' C OH R'' Eteri + R O Na + R' L R O R' + + Na L- Fenoli I composti che contengono l’ossidrile legato direttamente ad un anello aromatico non sono alcooli, ma fenoli Il fenolo è un composto industrialmente molto importante in quanto è il OH di numerosi prodotti commerciali che prodotto di partenza per la sintesi vanno dall’aspirina ad alcuni tipi di materie plastiche. ONa Cl + + 2 NaOH ONa NaCl + H2O + H2 O OH HCl + SO3Na NaCl ONa + 2 NaOH HCl + Na2SO3 Fenoli L’acidità dei fenoli è nettamente superiore rispetto a quella degli alcooli. OH OH Ka ~ 10-18 Ka = 1,3 x 10-10 HO OH O 2 + I fenoli che hanno gruppi ad attrazione elettronica (-Cl oppure 2) legati OH + NaOH O Na O + H–NO 2 all’anello benzenico sono più acidi del fenolo. A loro volta i fenoli con gruppi a H2 O + H3O+sostituito. rilascio elettronico (ad es.+–CH 3) sono meno acidi del fenolo non OH OH + OH OH NaOH O Na + H2 O O OH Ka = 1,3 x 10-10 + Cl H2 O Cl Ka = 6,3 x 10-10 Ka = 1,6 x+10-9H3 O+ + H2 O Aldeidi e chetoni Aldeidi e chetoni sono caratterizzati dal gruppo funzionale carbonilico e sono pertanto raggruppati sotto il nome di composti carbonilici. Gli elettroni del doppio legame C=O, unendo due atomi di elettronegatività molto diversa, sono addensati sull'atomo più elettronegativo, l'ossigeno; il gruppo carbonilico è fortemente polarizzato Inoltre, la geometria trigonale-planare, correlata all'ibridazione sp2 dell'atomo di carbonio, fa sì che il gruppo carbonilico offra ampi spazi d'accesso per un reagente. Aldeidi e chetoni: preparazione Il metodo classico per la preparazione di aldeidi e chetoni è l'ossidazione degli alcoli primari e secondari L'ossidazione viene quindi condotta in soluzione acquosa, ad una temperatura vicina a quella di ebollizione dell'aldeide: non appena l'aldeide si forma, questa distilla e lascia l'ambiente di reazione. Aldeidi e chetoni si possono preparare per ozonolisi degli alcheni R'' R C C R' H O3 Zn, H2 O R'' R C O R' + O C H Aldeidi e chetoni: addizione nucleofila Si noti che la reazione di addizione nucleofila al gruppo carbonilico è generalmente reversibile. Ovviamente l'addizione al gruppo carbonilico potrebbe essere iniziata altrettanto bene da un attacco elettrofilo sull'ossigeno. In effetti, ciò è quanto si può osservare nell'addizione nucleofila catalizzata da acidi. La catalisi acida tuttavia assume una certa importanza solo quando l'acido (l'elettrofilo) è H+ (o un acido di Lewis) e il nucleofilo non è molto forte Aldeidi e chetoni: reazioni I composti carbonilici possiedono una strutturale tendenza ad essere attaccati dai reagenti nucleofili. A questa proprietà ne possiamo aggiungere un’altra di carattere generale, la quale riguarda l’insolita acidità degli atomi di idrogeno legati ai carboni adiacenti al gruppo carbonilico. (idrogeno α) O H R C CHR' O O B R C CHR' R C CHR' Quando un protone reagisce con questo anione stabilizzato per risonanza, esso può interagire con due differenti centri basici. O R C C R H O R C C R H2 Tautomeria cheto-enolica OH R C C R H Acidi carbossilici Struttura generale Gruppo funzionale Derivati degli acidi carbossilici Dove Z potrebbe essere molte cose Derivati carbossilici Cloruro acilico Estere Amide Anidride Gruppo Acilico Nomenclatura degli acidi Trovare la catena più lunga di atomi di carbonio che contiene il gruppo COOH Sostituire la desinenza –o del nome dell’idrocarburo con la desinenza –oico ed anteporre al nome la parola acido Numerare e nominare le catene lineari o gli altri sostituenti Numerare con il numero 1 il carbonio carbonilico Nominare e numerare gli altri sostituenti Cloruri acilici Il gruppo –OH dell’acido è sostituito con il -Cl Secondo la nomenclatura si dovrebbe anteporre la parola acido ma si usa la desinenza –oile anteponendo al composto cloruro Cloruro butanoile Cloruro benzoile Esteri Propilbutanoato propile Da Anidride dell’acido Formato dalla combinazione di due acidi e la perdita di una molecola di acqua H+ , temperatura Acido 2-etanoico Anidride etanoica Ammidi O O O C NH2 CH3CH2CH2C NH2 CH3C NH2 Acetammide o Butanammide benzammide etanammide Se gli idrogeni dell’atomo di azoto ammidico sono sostituiti con gruppi alchilici, si antepongono al nome dell’ammide di base le lettere N-, o N,Nseguite dal nome dei radicali alchilici O CH3C N CH3 CH3 N,N-Dimetilacetammide O CH3C NHC2H5 N-Etilacetammide Proprietà Acidi - Molto polari con punti di ebollizione elevati - Presenta il legame idrogeno - Può avere forma dissociata Proprietà Derivati - Cloruri di acidi : nocivi, irritanti, debolmente polari, reagiscono violentemente con acqua - Esteri : debolmente polari, gradevole odore, le specie a basso peso molecolare sono solubili in acqua - Anidridi di acidi : non sono nè troppo polari nè troppo acide, si possono decomporre in acqua -Ammidi : sono in grado di formare forti legami ad idrogeno, perciò hanno punti di ebollizione e di fusione elevati. Fonti degli acidi carbossilici Fonti naturali Acido formico – formiche Acidi a basso peso molecolare – frutti aspri ed agrumi Acidi grassi – nei grassi, latte e piante oleifere Acido citrico Acido lattico Fonti artificiali Aldeidi Agente ossidante Alcooli primari Alcool primario Aldeide Acido carbossilico Reazioni di acidi carbossilici Sono tutti acidi deboli Dissociazione in acqua Ione carbossilato Le Ammine ed i Sali di Ammonio Ibridizzazione sp3 N H H N H H H CH 3 H3C CH 3 H3C H3C N CH 3 Trimetilammina (un' ammina terziaria) H3C H3C CH 3 Dimetilammina (un' ammina secondaria) Metilammina (un' ammina primaria) Ammoniaca N H Cl N + _ CH 3 Cloruro di Tetrametilammonio (un sale di ammonio quaternario) Nomenclatura delle Ammine CH3 H3C C NH2 CH3 terz.Butilammina NH2 H2NCH2CH2CH2CH2NH2 Cicloesilammina 1,4-Butandiammina O NH2 COOH CH3CH2CHCOOH 4 3 2 NH2 1 H2NCH2CH2CCH3 4 3 21 4-Ammino-2-butanone Acido 2-Amminobutanoico NH2 Acido 2,4-Diamminobenzoico Nomenclatura delle Ammine H N H3CH2C N CH2CH3 CH2CH3 Difenilammina Trietilammina CH2CH3 H3C N H3C N CH2CH2CH3 H3C N,N-Dimetilpropilammina N-Etil-N-metilcicloesilammina Nomi Comuni di Alcune Ammine Eterocicliche N N N N H Piridina Pirrolo N H Imidazolo N Pirimidina N N N Purina N H N H N Chinolina Indolo Proprietà delle Ammine Punti di ebollizione Composto CH3CH3 CH3OH CH3NH2 CH3CH2CH3 CH3CH2OH CH3CH2NH2 Peso Molecolare 30 32 31 44 46 45 Punto di ebollizione, C -88.6 65 -6.0 -42 78.5 16.6 La Basicità delle Ammine RNH2 Keq.= RNH3+ + OH- + H2O [RNH 3+] [OH-] [RNH 2] [H2O] Kb= pKb = -log Kb [RNH 3+] [OH-] [RNH 2] pKb + pKa = 14 Ammina Struttura pKb pKa (acido coniugato) Dietilammina (CH3CH2)2NH 3.06 10.94 Trietilammina (CH3CH2)3N 3.21 10.79 Etilammina (CH3CH2)NH2 3.25 10.75 Dimetilammina (CH3)2NH 3.27 10.73 Trimetilammina (CH3)3N 3.36 10.64 Metilammina CH3NH2 4.21 9.79 Ammoniaca NH3 4.74 9.26 Anilina PhNH2 9.37 4.63 p-NO2-Anilina p-NO2-PhNH2 13.0 1.0 Base più Forte Base meno Forte Le Reazioni delle Ammine Formazione dei sali di arendiazonio: + N N NH2 + HNO2 + H2SO4 Anilina Acido nitroso HSO4 - + 2H2O Bisolfato di benzendiazonio Le Reazioni dei Sali di Arendiazonio Sostituzione + N N + _ Nu Nu + N2 Le Reazioni dei Sali di Arendiazonio Sostituzione I OH H2O NaI + N H N H3PO2 CuBr Benzendiazonio KCN HCl CuCN CN Br HBr CuCl Cl Le Reazioni dei Sali di Arendiazonio La reazione di copulazione: CH3 + N CH3 N CH3 N CH3 + Benzendiazonio N N N N,N-Dimetilanilina p-(Dimetilammino)azobenzene
Scaricare