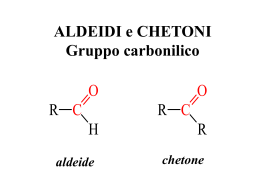
Chimica Organica Informazione Scientifica sul Farmaco Capitolo 12 Aldeidi e chetoni Organic Chemistry, 5th Edition L. G. Wade, Jr. Prentice Hall Organic Chemistry, 3rd Edition Paula Y. Bruice, Prentice Hall Aldeidi e chetoni • Aldeidi e chetoni cono caratterizzati dalla presenza del gruppo carbonilico (C=O) • Sono composti molto diffusi in natura • Usati come aromi e additivi, ad esempio vaniglia, cannella. • Presente nei farmaci • La formaldeide è usata per i polimeri, ad esempio la Bakelite. • Reattività chimica elevata, estremamente utile nelle sintesi organiche Noretindone: presente nella pillola contraccettiva perché 2 arresta l’ovulazione Struttura del carbonile • • Il Carbonio e l’ossigeno sono ibridizzati sp2. Il legame C=O è più corto, più forte e più polare del legame C=C. • Torneremo in seguito sulle caratteristiche elettroniche del gruppo carbonilico 3 Nomi IUPAC dei chetoni • • • • Individuare la catena più lunga che contenga il gruppo carbonilico. Numerare la catena in modo da dare il numero più piccolo possibile al carbonile. Nei chetoni ciclici il carbonile è in posizione 1. Sostituire la -o con -one. O CH3 O C CH CH3 CH3 O CH3 3-metil-2-butanone 4-idrossi-3-metil-2-butanone C CH CH2OH CH3 Br 3-bromocicloesanone 4 Nomenclatura delle aldeidi • • • IUPAC: Sostituire la -o con -ale. Il carbonio aldeidico è il numero 1. Se il gruppo -CHO è direttamente legato ad un anello, usare il suffisso -carbaldeide. CH3 CH2 CH3 O CH CH2 C H CHO 3-metilpentanale 2-ciclopentencarbaldeide 5 Quando il carbonile è sostituente • Quando ci sono gruppi a priorità maggiore, il C=O è sostituente e si chiama oxo-, mentre il -CHO si chiama formil. • La priorità delle aldeidi è maggiore di quella dei chetoni. COOH CH3 O CH3 O C CH CH2 C H 3-metil-4-ossopentanale CHO Acido 3-formilbenzoico 6 Nomi comuni dei chetoni O CH3 O O C C C CH3 CH3 acetofenone acetone benzofenone Nomi comuni delle aldeidi • Derivano dai nomi comuni degli acidi corrispondenti. 1 C: acido formico, formaldeide 2 C: acido acetico, acetaldeide 3 C: acido propionico, propionaldeide 4 C: acido butirrico, butirraldeide. 7 Punti di ebollizione • • Più polari degli alcani, quindi punti di ebollizione più alti. Non possono formare legame idrogeno intermolecolare, per cui bollono a temperature inferiori rispetto ai corrispondenti alcoli. 8 Solubilità • • • Buoni solventi per gli alcoli. Accettori di legami ad idrogeno, ad esempio con O-H o N-H. Acetone e acetaldeide sono miscibili con l’acqua in tutte le proporzioni. d- d- O H d+ O H Legame idrogeno 9 Sintesi (review) • • Ossidazione degli alcoli alcol 2 + Na2Cr2O7 chetone alcol 1 + PCC aldeide Acilazione di Friedel-Crafts Cloruro acilico/AlCl3 + benzene chetone CH3COCl O C CH3 AlCl3 10 Reattività del carbonile • La polarizzazione e la mesomeria del carbonile indicano che il carbonio ha carattere elettrofilo • Reagisce con i nucleofili • L’attacco nucleofilo determina la rottura del legame p • Si forma un prodotto di addizione dR O O C C H R O d+ H R C H Nu Nu 11 Addizione nucleofila • Un nucleofilo forte attacca il gruppo carbonilico formando uno ione alcossido, che successivamente viene protonato. • Le aldeidi sono più reattive dei chetoni. 12 Addizione di acqua • • • • Reazione catalizzata sia dagli acidi che dalle basi In ambiente acido il nucleofilo è l’acqua. In ambiente basico il nucleofilo è lo ione idrossido. Le aldeidi sono più elettrofile. O H C HO + H2O H O CH3 C CH3 C H HO + H2O OH CH3 H K = 2000 OH C CH3 K = 0.002 13 Addizione di alcoli • • • • • Reazione molto importante per la comprensione della chimica dei carboidrati E’ catalizzata dagli acidi. L’addizione di H+ al carbonile lo rende reattivo nei confronti dei nucleofili deboli come ROH. Prima si forma un emiacetale, poi si ha una seconda addizione di ROH con formazione di un acetale. Tutti passaggi reversibili. 14 Meccanismo 15 Acetali ciclici • L’addizione di un diolo porta alla formazione di un acetale ciclico. • Gli zuccheri normalmente si trovano in forma emiacetalica. OH OH H O Carbonio emiacetalico H H H OH H OH OH 16 Ossidazione delle Aldeidi Facilmente ossidabili ad acidi carbossilici. 17 Riduzioni dei composti carbonilici: riducenti • • • Sodio Boroidruro, NaBH4, riduce C=O, non riduce C=C. Litio Alluminio Idruro, LiAlH4, molto più reattivo, difficile da maneggiare. H2 e catalizzatore, riduce anche C=C. O CH3CH2CH2C OH H NaBH4 H2O CH3CH2OH HCl O CH3CH2CH2CH2 OH NaBH4 H2O CH3CH2OH HCl 18 Acidità degli idrogeni a • I composti carbonilici che hanno un idrogeno in posizione a sono acidi deboli, pKa 15-20. a Carbonyl compound CH3CH2COCH2CH3 CH3COCH3 PhCOCH3 PhCH2COCH3 PhCH2COCH3 Cyclohexanone CH3CHO Pka 19,9 18,9 17,7 18,3 15,9 17,8 16,5 19 Acidità degli idrogeni a Ad esempio il butanale (aldeide butirrica) potrebbe formare 3 diversi anioni, ma solo il primo è stabilizzato dalla risonanza 20 Tautomeria cheto-enolica La forma carbonilica è in equilibrio con la forma enolica. L’equilibrio è catalizzato dalle basi o dagli acidi 21 Reazione aldolica L’anione enolato può reagire con una seconda molecola di aldeide o chetone formando un aldolo o un chetoalcol 22 Fine del capitolo 12 23
Scaricare