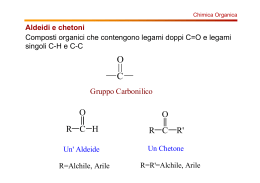
ALDEIDI e CHETONI Gruppo carbonilico O R C O R C H aldeide R chetone ALDEIDI e CHETONI contengono il gruppo CARBONILE Nelle aldeidi è su un carbonio primario Nei chetoni è su un carbonio secondario Gruppo carbonilico Nomenclatura Nelle aldeidi la desinenza e’ -ale Nomenclatura Nei chetoni la desinenza e’ -one Il gruppo sostituente RCO- è chiamato alcanoile o acile Nomenclatura Quando un chetone è un sostituente in catena si riferisce ad esso come gruppo osso. O O 1 H 5 esanale 5-ossoesanale Mentre quando l’aldeide è il sostituente di un anello ci si riferisce ad essa come carbaldeide O H cicloesancarbaldeide Nomenclatura Se il gruppo carbonilico viene considerato il sostituente in una catena ci si riferisce come gruppo acilico ed il nome è formato dal suffisso -il. O O H Me acetil formil O benzoil Reagenti e prodotti comuni I reagenti piu comuni: • Formaldeide ed Acetaldeide • Acetone Composti naturali p R s H xy R H C O p R2 s R1 xy R2 R1 C O Polarizzazione del carbonile O R C O R C R Risonanza fra due forme limite R d- d+ Il gruppo carbonile Il legame C=O è molto polarizzato: La polarità delle molecole ne diminuisce la volatilità rispetto agli alcani corrispondenti legami idrogeno: Le molecole non possono darli ma possono riceverli (ad esempio dall’acqua) Proprietà fisiche di aldeidi semplici e chetoni Reattività del gruppo carbonilico: addizione nucleofila Più reattiva un aldeide o un chetone?? Nu: Nu: Le aldeidi sono più reattive perché i sostituenti alchilici sono gruppi donatori che diminuiscono la parziale carica positiva sul carbonio carbonilico. La minore reattività dei chetoni deriva anche da un maggior ingombro sterico. Addizione nucleofila Gli acidi catalizzano l’addizione nucleofila per protonazione dell’ossigeno Addizione di alcoli: semiacetali ed acetali Acetali In presenza di un eccesso di alcol i semiacetali reagiscono ulteriormente fornendo gli acetali. L'ossidrile del semiacetale viene sostituito da un gruppo alcossile. Negli acetali due funzioni eteree sono presenti sullo stesso atomo di carbonio. Il meccanismo consiste nei due stadi seguenti: Semiacetali ciclici Composti con un gruppo aldeidico e un ossidrile a distanza appropriata all’interno della stessa molecola sono in equilibrio col semiacetale ciclico che si forma per addizione nucleofíla intramolecolare. L'ossidrile si trova in posizione favorevole per poter agire da nucleofilo sul carbonio con un meccanismo specifico: I composti nei quali l'ossidrile dista quattro o cinque atomi di carbonio dal gruppo aldeidico hanno una forte tendenza a formare semiacetali ed acetali ciclici, perché gli anelli a cinque e a sei termini sono privi di tensioni. g b H O d a C O H 5-idrossipentanale d-ossialdeide Le g- e le d-ossialdeidi possono formare emiacetali ciclici stabili C H O H +O O O C H H O C H OH - OH O O C OH C O H H R H C si ottengono due emiacetali enantiomeri C OH O H C C H O OH S Glucosio Reazioni • • • • • Idratazione. Addizione di Azoto derivati. Riduzione dai carbonili Ossidazione Saggio di Tollens Idratazione (addizione) L'acqua, come gli alcoli, è un nucleofilo all'ossigeno e può addizionarsi in modo reversibile alle aldeidi e ai chetoni. La formaldeide in acqua esiste prevalentemente in forma idrata. (un gem-diolo) L’addizione nucleofila di acqua ad un’aldeide in ambiente alcalino, il cui meccanismo è questo : H R - OH H R C OH C O O H H2O R C OH OH- OH aldeide idrata porta alla formazione di una aldeide idrata (gem-diolo) Addizione di acido cianidrico L'acido cianidrico si addiziona al carbonile delle aldeidi e dei chetoni per formare le cianidrine Il carbonio dell’acido cianidrico indissociato non può comportarsi da nucleofilo, è necessaria una base. Il carbonio non possiede doppietti elettronici non condivisi. La base trasforma una parte dell'acido cianidrico in ione cianuro, che si comporta da nucleofilo sul carbonio. OH- HCN CN- C N C N H H3C C O H+ C H3C H OH Sinister H H3C C O C N H+ OH H H3C C C N Rectus Addizione di Azoto derivati L'ammoniaca, le ammine e alcuni loro derivati hanno sull'atomo di azoto un doppietto elettronico non condiviso e si comportano da nucleofili. Il prodotto tetraedrico di addizione che si forma nel primo passaggio è simile a un semiacetale Riduzione dei carbonili Le aldeidi e i chetoni vengono facilmente ridotti ad alcoli primari e secondari. Il più delle volte si ricorre agli idruri metallici. Esempio: Ossidazione Le aldeidi si ossidano molto più facilmente dei chetoni. Per ossidazione di un'aldeide si ottiene un acido con lo stesso numero di atomi di carbonio: Esempio: Il saggio di Tollens Un saggio che distingue le aldeidi dai chetoni in base alla loro differente ossidabilità è il saggio di Tollens dello specchio d'argento. Lo ione argento complessato dall'ammoniaca è ridotto dalle aldeidi (ma non dai chetoni) ad argento metallico Ci si serve di questa reazione per argentare il vetro: l'aldeide usata è la formaldeide, a causa del suo basso costo. Tautomerismo Cheto-Enolico • un carbonio adiacente a un gruppo carbonilico è chiamato carbonio-a, e un idrogeno legato ad esso è un idrogeno-a. a- hydrogens O CH3 - C- CH 2 - CH 3 a- carbons Tautomerismo Cheto-Enolico Un composto carbonilico con un idrogeno-a è in equilibrio con un isomero chiamato enolo (en da alchene + olo da alcohol) • Può formare lo ione enolato O OH CH 3 - C- CH3 CH3 - C= CH 2 Acetone (keto form) Acetone (enol form) Tautomeria Cheto-Enolica Aldeidi e chetoni possono esistere all'equilibrio come miscela di due forme: chetonica ed enolica. Le due forme differiscono per la posizione di un protone e di un doppio legame e vengono dette tautomeri: 2,4-pentanedione: forma enolica stabilizzata da H-bond Tautomerismo Cheto-Enolico Gli equilibri per aldeidi semplici stanno dalla parte della forma chetonica Keto form O CH3 CH Enol form % Enol at Equilibrium OH CH2 = CH 6 x 10-5 OH O CH3 CCH3 O CH3 C= CH2 6 x 10-7 OH 4 x 10-5 Tautomerismo Cheto-Enolico • Il tautomerismo è catalizzato dagli acidi Step 1: trasferimento di protone da H-A + •• H O •• •• O H- A A- CH3 - C-CH3 + •• CH3 - C-CH3 + keto form fast the conjugate acid of the ketone Step 2: trasferimento di protone a A- + A- •• CH3 - C-CH2 - H •• + •• H O slow •• OH CH3 - C= CH2 Enol form + H- A Racemizzazione Racemizzazione al carbonio-a è catalizzata da acido Ph O C C H3 C CH3 H (R)-3-Phenyl-2butanone OH Ph C H3 C Ph O C C CH3 An achiral enol C H CH3 H3 C (S)-3-Phenyl-2butanone Tautomerizzazione di un’aldeide in ambiente basico H H H H C H C C O H forma carbonilica H C - H H C H OH H forma enolica HOH H O H OH- H HOH O H H C O H C C OH C C H C H H C O Acidità degli H in a l'anione risultante è stabilizzato per risonanza Nell’anione enolato la carica negativa si distribuisce fra il carbonio in alfa e l'atomo di ossigeno carbonilico. Acidità degli H in a Condensazione aldolica L’acetaldeide reagisce con NaOH diluito a dare un dimero: il 3-idrossibutanale, che è un aldolo (aldeide + alcol) L’aldolo per riscaldamento si può disidratare a dare un alchene, in cui il doppio legame è coniugato con quello carbonilico 1) H H aC C H H H OH- C C C C O H2O H H H H O O H Nella prima tappa si produce un anione enolato ... H 2) H C C H H H H H H H C C C C C C O O H O H H H …che nella tappa successiva compie un attacco nucleofilo su una seconda molecola di aldeide. H H H 3) H H C C C C H O H O H H2O OH- H H H H H C C C C H OH H O Nell’ultima tappa della reazione si forma una b-idrossialdeide. O H 2 H3C C O - OH H H H H2O H3C O H C C H3C C C C OH H H C H O etanale 3-ossibutanale (aldolo) trans-2-butenale (aldeide crotonica) - CH3 OH 2 H3C C O CH3 H CH3 H3C C C C O OH H 4-metil-4-ossi-2-pentanone (aldolo) H2O H H3C C C H3C C CH3 O 4-metil-3-pentene-2-one Meccanismo di addizione aldolica • Lo ione enolato con carica negativa sul C agisca da nucleofilo al C-carbonilico. Forma nuovi legami C-C FINE
Scarica