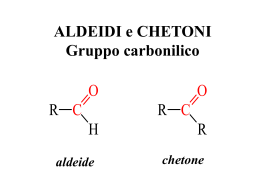
Composti Carbonilici Aldeidi e Chetoni RCHO; RCRO ALDEIDI e CHETONI • Sono caratterizzati dalla presenza del gruppo carbonilico che consiste in un atomo di carbonio legato con un doppio legame ad un atomo di ossigeno O R C O R C H aldeide R chetone Aldeidi C O • Il gruppo CARBONILICO nelle aldeidi è legato ad almeno un atomo di idrogeno • (carbonile primario) CHO C O H H R C O H Formaldeide Gruppo aldeidico Ar C O H Aldeide alifatica C O H Aldeide aromatica Generalità • Il gruppo CARBONILICO nei chetoni è legato sempre a due atomi di carbonio e quindi a due gruppi che possono essere alchilici o arilici C O • (carbonile secondario) R R C O Ar C O R chetone alifatico Ar aril alchil chetone C O C O Ar chetone aromatico chetone ciclico Nomenclatura • Per le aldeidi si identifica la catena contenente il gruppo carbonilico e si aggiunge il suffisso –ale O O 2 H 1 H metanale (formaldeide) 1 O H 3 etanale (acetaldeide) 2 1 O O H 3 4 propanale (propionaldeide) 2 1 H butanale (n-butirraldeide) 4 2 3 3 4 O 3 2 1 3-butenale H HO 2 3 1 4 2 H OH 2,3-diidrossipropanale 1 H 3-metilbutanale H O 1 O O H 5 ciclopentancarbaldeide (formilciclopentano) benzaldeide (benzencarbaldeide) • La posizione del gruppo carbonilico non va specificata perché per le aldeidi è sempre la posizione 1 Nomenclatura • Per i chetoni si identifica la catena contenente i gruppo carbonilico e si aggiunge il suffisso –one O 3 2 O 4 1 3 2 O O 1 4 5 2 3 3 1 butanone 3-pentanone propanone (dimetilchetone) (etilmetilchetone) (dietilchetone) (acetone) O O O 1 5 cicloesanone fenilmetilchetone (acetofenone) 4 4 2 1 3-buten-2-one (metilvinilchetone) O 2 3 difenilchetone (benzofenone) 2-metilciclopentanone • Per i chetoni più semplici si identificano i due gruppi legati al gruppo carbonilico e si aggiunge la parola chetone Nomenclatura Quando il gruppo carbonilico C O è presente insieme ad altri gruppi più importanti deve essere considerato come un sostituente della catena e viene identificato come gruppo osso. O O 6 5 4 3 2 1 H 3-metil-5-ossoesanale H C O Mentre quando un gruppo aldeidico è attaccato ad un anello ci si riferisce ad esso come O carbaldeide 2 3 O 1 H H 4 5 ciclopentancarbaldeide (formilciclopentano) benzaldeide (benzencarbaldeide) Nomenclatura Nella nomenclatura comune alcuni gruppi contenenti il carbonile derivano il nome dal loro corrispondente acido carbossilico e vengono considerati come sostituenti (gruppi acilici) O 2 O 3 OH H H acido formico gruppo formilico O O 1 4 5 O Acetilciclopentano O O OH H3C H3C acido acetico gruppo acetilico CH3 OH acido benzoico gruppo benzoilico Esempi O H 1 8 7 6 5 4 3 2 1 H HO 4 1 CHO (2E)-3,7-dimetil-2,6-ottadienale (geraniale) HO 4 H trans-4-idrossicicloesancarbaldeide H CHO O H trans-3-fenil-2-propenale (cinnamaldeide) dicicloesilchetone CHO Reagenti e prodotti comuni • Le aldeidi e i chetoni più comuni sono: – La formaldeide che è un gas che si trova in commercio H come soluzione acquosa (formalina) perché tende a H polimerizzare, che viene usata come disinfettante e formaldeide conservante o nella produzione di polimeri O O H3C – L'acetaldeide che viene usata per la produzione di altri H prodotti chimici (acido acetico, butanolo, ecc.) acetaldeide O – L'acetone che viene usato come solvente in quanto H3C CH3 scioglie molte molecole organiche ed è miscibile con acetone l'acqua Reagenti e prodotti comuni • I chinoni sono i prodotti che derivano dall'ossidazione dei fenoli e sono dichetoni coniugati ciclici: – Essi sono colorati e spesso vengono usati come pigmenti Alizarina – Alcuni sono biomolecole indispensabili per l'organismo Fillochinone (Vitamina K) Ubichinone Composti naturali O O O H MeO H H H H HO Benzaldeide (olio di mandorle) H3C CH3 Aldeide cinnamica (cannella) Vanillina (vaniglia) O O H3C O Canfora C C C C C H2 H H H2 H3 CH3 jasmone (gelsomino) Carvone (essenza di menta) Gruppo carbonilico • L’atomo di carbonio carbonilico è ibridato sp2 e forma angoli di legame di circa 120°. • I tre atomi legati all’atomo di carbonio carbonilico si trovano sullo stesso piano. Polarità • L’atomo di ossigeno è legato con un doppio legame e porta due doppietti elettronici • A causa della sua maggiore elettronegatività esso polarizza il legame con l’atomo di carbonio fino a spostare completamente gli elettroni π su di sé Proprietà fisiche • La polarità rende le aldeidi ed i chetoni meno volatili rispetto agli alcani corrispondenti • Infatti aumentando la polarità aumentano le interazione dipolo-dipolo tra le varie molecole. Proprietà fisiche • I composti carbonilici possono inoltre proprio a causa della loro polarizzazione, dare legami idrogeno con composti contenenti gruppi H-O- (ad esempio l’acqua o gli alcoli) Proprietà fisiche • La possibilità di formare legami idrogeno li rende abbastanza solubili in acqua Reattività Oδ R C − δ+ C O R H H R C + C R H H • Subiscono attacco da parte di nucleofili • Vengono facilmente protonati sull'ossigeno carbonilico • Possono donare protoni legati in α A causa della polarizzazione del legame π H+ O + R C C R :Nu H H :B Addizione nucleofila • I composti carbonilici a causa della parziale carica positiva sull'atomo di carbonio carbonilico possono subire attacco da parte dei nucleofili • Gli elettroni π si spostano sull’atomo di ossigeno Oδ− R δ+ R' + H .. Nu O R' R H OH Nu + R' R Nu • Quando la reazione viene condotta in un solvente protico, o con un reagente protonato, si ha la protonazione dell’ossigeno carbonilico che porta la carica negativa Addizione nucleofila • La reazione completa sarà quindi una reazione di addizione. • L’atomo di carbonio carbonilico passa da una ibridazione sp2 nel reagente ad una ibridazione sp3 nel prodotto. O R .. R' + H Nu O H R R' Nu Effetto della struttura • Le aldeidi reagiscono meglio dei chetoni sia per effetto elettronico che per motivi sterici H R O R O > H H R Effetto elettronico H δ + δC O H R δ+ δC O > H R > O > Ingombro sterico δ+ δC O > piano R R O H + > δ+ H O δO O H - Nu* R' R Nu tetraedrico Catalisi acida • Le reazioni di addizione nucleofila possono essere catalizzate dagli acidi che protonano l'atomo di ossigeno carbonilico e rendendo interamente positivo l'atomo di carbonio carbonilico che subisce così meglio l’attacco del nucleofilo O R OH R' + +H R + .. R' + H Nu OH R Nu H + OH - +H R' R' R Nu Catalisi basica • Anche le basi catalizzano la reazione in quanto possono deprotonare il nucleofilo e renderlo così più reattivo nei confronti dell’atomo di carbonio carbonilico B + HNu O R δ+ - Nu δ− R' O + - Nu + BH+ R' R Nu OH + BH+ R' R -B Nu Addizione di nucleofili all ’ossigeno all’ossigeno Reazioni di addizione/eliminazione Addizione di acqua • L'addizione di acqua porta alla formazione di gem-dioli. La reazione è una reazione di equilibrio ed è più o meno spostata a destra a seconda dei reagenti e delle condizioni di reazione O R R' .. + HO H OH O R R' HO + H R R' OH gem-diolo Addizione di acqua • Può essere catalizzata dagli acidi e dalle basi O R R' .. + HO H OH + H+ R R' HO + - H+ H OH Catalisi acida R OH Catalisi basica O R R' .. + HO H R' .. +B OR - BH+ + BH+ R' OH - :B Addizione di acqua • Le aldeidi ed i chetoni in soluzione acquosa sono sempre presenti in una certa percentuale nella forma idratata. % IDRATAZIONE H O H H3C > O H 100% H3C O > H3C 58% 0% La reazione è reversibile La formaldeide in acqua è completamente idratata ma può essere distillata da una sua soluzione acquosa Addizione di alcoli • L'addizione di un alcol porta alla formazione di un derivato che contiene sullo stesso atomo di carbonio una funzione alcolica e una eterea che prende il nome di emiacetale (da aldeide) o emichetale da (chetone). OH R O + R'OH H R H OR' emiacetale Addizione di alcoli O- R O + R'OH R H OH R H R'O + H H OR' emiacetale La reazione avviene meglio in presenza di catalisi acida O R OH H + +H R + .. H + HO R' OH R OH - +H H +O H R' R H OR' La reazione è reversibile (tutti gli stadi) Addizione di alcoli In presenza di catalisi acida e di un eccesso di alcol la reazione non si ferma dopo lo stadio di addizione ma si ha anche la sostituzione del gruppo –OH formatosi nel primo stadio con un gruppo –OR attraverso una reazione di sostituzione nucleofila alchilica con meccanismo SN1 H OH R +OH H+ H R veloce OR' H + OR' - H2O H OR' R lenta SN1 + H + R'OH OR' R veloce H OR' OR' - H+ R veloce H OR' acetale emiacetale Il prodotto che si forma possiede due funzioni eteree sullo stesso atomo di carbonio e si chiama ACETALE. ACETALE La reazione è reversibile (tutti gli stadi) Addizione di alcoli R O + R'OH R OH + H+ R OR' + H+ R + R'OH OR' emichetale R - H2O R OR' chetale La reazione avviene più lentamente sui chetoni anche con catalisi acida e porta alla formazione di EMICHETALI e di CHETALI Addizione di alcoli La reazione sui chetoni avviene meglio utilizzando dioli e in questo caso porta alla formazione di un CHETALE CICLICO R O + R HO H+ R O + H2O HO R O La reazione viene usata per proteggere gruppi funzionali R O + R HO R' HO R' tre molecole H+ R OR' + H2O R OR' due molecole Addizione di alcoli Eccesso di EtOH e acido anidro (HClg) La rimozione di alcol favorisce la formazione del chetone Acidi diluiti L'assenza di acqua aggiunta e la sua rimozione durante la reazione favorisce la formazione dell'acetale L'aggiunta di acqua favorisce la formazione del chetone Semiacetali ciclici Composti con un gruppo aldeidico e un ossidrile a distanza appropriata all’interno della stessa molecola sono in equilibrio con l’emiacetale ciclico che si forma per addizione nucleofila intramolecolare. 2 O 1 C H 3 4 OH OH CH O 5 5-idrossipentanale emiacetale 2-idrossitetraidropirano L'ossidrile si trova in posizione favorevole per poter agire da nucleofilo sul carbonio carbonilico. γ- e δ-ossialdeidi • I composti nei quali l'ossidrile dista quattro (γ-ossialdeidi) o cinque (δ-ossialdeidi) atomi di carbonio dal gruppo aldeidico hanno una forte tendenza a formare semiacetali ed acetali ciclici, perché gli anelli a cinque e a sei termini sono privi di tensioni. γ β δ α C H H O O O+ O H 5-idrossipentanale δ-idrossialdeide C H C H O O H Zuccheri semplici O CH H HO OH H H OH H OH CH2OH HO HO β γ HO α HO O C H δ OH CH2OH HO HO OH CH O CH2OH Zuccheri semplici CH2OH CH2OH O O HO HO H H OH H OH H OH H OH C OH H2 C OH H2 O HO α OH CH2OH OH β HO H γ CH2OH HO CH2OH O HO HO CH2OH O HO HO CH2OH OH β γ HO α OH CH2OH HO O δ HO Disaccaridi • La formazione degli acetali negli zuccheri porta alla formazione dei disaccaridi e dei polisacccaridi HO HO OH OH OH HO HO O O OH OH OH OH β-D-glucopiranosio - HO H HO HO O OH O O OH HO OH OH Addizione di nucleofili all ’azoto all’azoto Reazioni di addizione/eliminazione Addizione di derivati dell’ammoniaca • La reazione dell’ammoniaca, delle ammine primarie e dei derivati dell’ammoniaca con le aldeidi ed i chetoni non si ferma al primo stadio di addizione R R O + :N H R' R R H R O R' N H H + R :N R' OH H R R N R' • Il prodotto di addizione (amminoalcol) non è stabile e dà eliminazione di una molecola di acqua + H2O Addizione di NH3 o NH2R • Il prodotto che si forma dall’addizione di ammoniaca o di un’ammina primaria si chiama immina R R H O + :N H R' R R - H2O OH N R' H R R N R' IMMINA Addizione di NH2OH • Il prodotto che si forma dall’addizione di idrossilammina (NH2OH) si chiama ossima R R H O + :N H OH IDROSSILAMMINA R - H2O OH R N H OH R R N OH OSSIMA ReazioneChetoni Fenilidrazina( Fenilidrazina(Lab).avi Lab).avi Addizione di NH2NHR • Il prodotto che si forma dall’addizione di idrazine (NH2-NHR) si chiama idrazone R R H O + :N H NHR' IDRAZINA R - H2O OH R N H NHR' R R N NHR' IDRAZONE • La reazione con 2,4-dinitrofenilidrazina viene utilizzata per convertire composti liquidi in solidi cristallini (2,4-dinitrofenilidrazoni) colorati Ammine secondari e terziarie • Con ammine secondarie e terziarie la reazione non avviene perché il prodotto di addizione non è stabile e non si può avere eliminazione di acqua (mancano i protoni legati all'azoto) R R O + :N R' R' R R H R O R' N H R' + R :N R' OH R' R R +N R' R' + HO- Immine biologiche • La forma attiva della vitamina A che è un’aldeide (retinale) è legata alla proteina opsina nella retina umana sotto forma di immina ed è chiamata rodopsina. Nella proteina il gruppo amminico viene fornito dall’amminoacido lisina HN O 2 Lisina + 11-cis-Retinale H O OH H2N H H2N Opsina Rodopsina H N Opsina Addizione di nucleofili al carbonio Reattivi di Grignard • Una soluzione di un alogenuro alchilico o arilico in etere reagisce con trucioli di magnesio per formare un reattivo in cui l’atomo di carbonio precedentemente legato all’alogeno porta una parziale carica positiva. δ+ δ− Cl + etere Mg δ− δ+ δ− Mg Cl Reattivo di Grignard • Questo in quanto il metallo fortemente elettropositivo si inserisce tra l’alogeno ed il carbonio e polarizza negativamente entrambi gli atomi Reattivi di Grignard • L’etere ha la funzione di stabilizzare il magnesio per coordinazione .. R O ..δ+ δ− R' Mg Cl δ− .. O .. R R R • Il reattivo di Grignard non si forma o si distrugge immadiatamente in presenza di acqua. • L’etere è un solvente che può essere anidrificato efficacemente. Addizione di Reattivi di Grignard • Il reattivo di Grignard può quindi reagire come nucleofilo al carbonio nei confronti di aldeidi e chetoni δO R' δ+ O R' + R MgX δ- δ+ R' MgX R' R H+/H2O OH R' + HO MgX R' R • La reazione è una tipica reazione di addizione • L’intermedio viene convertito nel prodotto finale che è un alcol per idrolisi acida La reazione viene usata per unire più gruppi di atomi di carbonio in quanto l’alcol che viene prodotto può essere poi convertito in un gran numero di altri prodotti Addizione di Acetiluri • Gli acetiluri si formano dalla reazione acido-base di un alchino con sodioammide. + NH2R C CH R C C - NH3 • Anche essi sono nucleofili al carbonio e possono dare una reazione di addizione su aldeidi e chetoni δO R' δ+ O Na R' + R C C Na + R' R' + H+/H2O OH R' R' C C C C R R Tautomeria cheto-enolica Acidità in α Il gruppo carbonilico ha la capacità di rendere leggermente acido l’atomo di carbonio in α: Questo in quanto la base coniugata che si forma è delocalizzata per risonanza. R O +:B/-BH+ R' R H R O R C R O R' R C R' carbanione delocalizzato Basi sufficientemente forti come gli alcolati sono in grado quindi di formare la base coniugata di un chetone che viene detta ione enolato Tautomeria cheto-enolica A causa di tale acidità i composti carbonilici che possiedono un a-idrogeno sono in equilibrio con il loro tautomero chiamato enolo (-en da alchene + -olo da alcol) H O H H O H R H Chetone H R Enolo I tautomeri sono composti che differiscono tra loro solo per la posizione di un protone e di legami π NON sono forme di risonanza Gli enoli possono reagire come nucleofili al carbonio Tautomeria cheto-enolica L'equilibrio è una reazione acido-base tra una molecola di chetone che funge da base e un'altra che funge da acido formando i loro coniugati che di nuovo si trasferiscono il protone ma in un altro sito della molecola base O H3C O CH3 + H3C acido CH3 H3C acido OH OH H2C base acido + OH CH3 + H2C CH3 CH3 H acido + O CH3 base O OH H2C + H2C base CH3 + H2C CH3 Tautomeria cheto-enolica L'equilibrio può essere catalizzato dagli acidi O H3C + OH + H+ CH3 Chetone - H+ H3C OH CH3 H3C + OH - H+ CH3 H2C + H+ Ambiente Acido CH3 Enolo o dalle basi O H3C +B CH3 Chetone - BH+ H2C O O CH3 H2C Ambiente Basico OH + BH+ CH3 -B H2C CH3 Enolo Tautomeria Cheto-Enolica • L’enolo è sempre presente in diversa percentuale nei diversi substrati carbonilici • L'equilibrio per le aldeidi ed i chetoni semplici è spostato verso la forma chetonica Tautomeria Cheto-Enolica • Infatti nell'enolo il protone è legato all'ossigeno (acido più forte) mentre nella forma chetonica è legato ad un atomo di carbonio (acido più debole). • Inoltre nella forma chetonica si ha un doppio legame carbonio-ossigeno che è più forte di un doppio legame carbonio-carbonio. • Un esempio in cui la forma enolica predomina nettamente sulla forma chetonica è quella del fenolo. Qui entra in gioco la stabilità del benzene OH O e quindi la formazione del chetone, sarebbe una reazione energeticamente molto sfavorita. H H Condensazione aldolica Gli enoli, essendo anche nucleofili al carbonio, possono addizionarsi al carbonile di un'altra molecola di aldeide formando una β-idrossialdeide H3C H + H2C OH O : OH O H H3C CH2 H H3C H CH2 + O H H H O β-idrossialdeide La reazione avviene bene con le aldeidi e meno bene con i chetoni Può portare alla formazione di polimeri Condensazione aldolica • La reazione può essere catalizzata sia dalle basi O H3C H - BH+ O O +B H + H3C H2C - OH O H H3C H + CH2 BH+ H CH2 -B O CH O CH aldeide H3C β-idrossialdeide • che dagli acidi O H H3C O O H3C OH H+ CH3 chetone H3C + H3C OH CH3 + H2C + CH2 CH3 HO CH3 CH3 - H+ CH2 HO CH3 CH3 β-idrossichetone Condensazione aldolica In condizioni acide o basiche più forti o a temperatura maggiore si ha disidratazione O H3C H C H O H+ H3C H3C - H2O H C H H C H + HO C CH3 + H O C CH3 CH3 H CH3 HO C CH3 CH3 β-idrossichetone H3C H C C CH3 CH3 CH3 chetone α,β insaturo O H C H - H+ C CH3 β-idrossichetone H3C O O O + OH- H2O H3C H C HO C CH3 CH3 O - OH- H3C H C C CH3 CH3 chetone α,β insaturo La reazione è una eliminazione Enoli • Gli enoli, inoltre, possono reagire come nucleofili al carbonio anche nei confronti di alogeni dando α-alogenazione H O H3C CH3 H2C + O OH CH3 + Br Br H2C Br CH3 + Br - HBr O H2C Br CH3 Enolati • In presenza di basi tale reazione è favorita dalla formazione dell'enolato che è un nucleofilo migliore dell'enolo R O +:B/-BH+ R' R R O R C R' H R O R C R O R' + Br Br R C Br R' + Br Riduzione • Le aldeidi e i chetoni vengono facilmente ridotti ad alcoli primari e secondari. Il più delle volte si ricorre agli idruri metallici ma si può usare anche l’idrogenazione catalitica. Ossidazione • Per ossidazione di un'aldeide si ottiene un acido carbossilico contenente lo stesso numero di atomi di carbonio. • I chetoni non vengono ossidati Il saggio di Tollens AldeidiEChetoni.avi • Il saggio distingue le aldeidi dai chetoni in base alla loro differente ossidabilità ed è detto dello specchio d'argento. • Lo ione argento complessato dall'ammoniaca è ridotto dalle aldeidi (ma non dai chetoni) ad argento metallico • Ci si serve di questa reazione per argentare il vetro: l'aldeide usata è la formaldeide, a causa del suo basso costo. Ossidazione
Scaricare