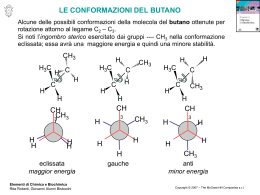
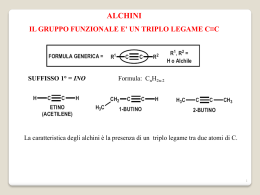
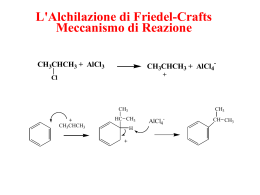
Reattività del carbonio sp3 Idrocarburi saturi o alcani – proprietà fisiche Nome Metano Etano Propano Butano Pentano Esano Eptano Ottano Nonano Decano Undecano Dodecano Tridecano Tetradecano Pentadecano Esadecano Eptadecano Octadecano Nonadecano Icosano Formula CH4 C2H6 C3H8 C4H10 C5H12 C6H14 C7H16 C8H18 C9H20 C10H22 C11H24 C12H26 C13H28 C14H30 C15H32 C16H34 C17H36 C18H38 C19H40 C20H42 P. Ebollizione °C -161 -88 -42 0 36 68 98 125 150 174 195 216 243 253 270 287 303 307 330 343 P.F. °C -183 -172 -188 -135 -130 -95 -91 -57 -54 -30 -26 -10 -5 6 10 18 22 28 32 36 Reazioni del metano A temperatura ambiente il metano non reagisce né con acidi forti né con basi forti. La differenza di elettronegatività tra C e H è piccola per polarizzare il legame covalente e attrarre cariche per dare reazioni. Il carbonio è al massimo stato di riduzione e non può essere ridotto ulteriormente; Neanche gli ossidanti comuni reagiscono col metano a temperatura ambiente. È un idrocarburo saturo (o anche paraffina), cioè poco reattivo. reazioni con il cloro , Cl CH4 + Cl2 DH° = -113 kJ/mole DG° CH3Cl + HCl DS° = -0,03 kJ/(mole°K) = DH° + T DS° = -104 kJ/mole (a25°C) Keq = 2 x 1018 La reazione è termodinamicamente favorita, ma non avviene a causa dell’energia di attivazione elevata CLORURAZIONE DEL METANO Se si irradia una miscela di metano e cloro con radiazione ultravioletta si ottiene una miscela di prodotti che comprendono vari composti del cloro: CH4 + Cl2 CH3Cl + Cl2 CH3Cl + HCl clorometano CH2Cl2 + HCl diclorometano cloruro di metilene CH2Cl2 + Cl2 CHCl3 + HCl CHCl3 + Cl2 CCl4 + HCl triclorometano cloroformio tetraclorometano tetracloruro di carbonio CLORURAZIONE DEL METANO – SOSTITUZIONE RADICALICA La radiazione ultravioletta provoca la rottura omolitica della molecola di cloro, con formazione di due radicali: hn Cl-Cl Cl· Reazione di iniziazione Cl· I radicali ci cloro sono molto reattivi e reagiscono col metano strappando un idrogeno, formando quindi un radicale metile. Il radicale metile reagisce ulteriormente con altro cloro propagando ancora il radicale. CH4 + Cl· CH3· + Cl2 CH3· + HCl CH3Cl + Reazioni di propagazione Cl· La reazione termina quando due radicali si combinano tra loro CH3· + Cl· CH3Cl CH3· + CH3· CH3-CH3 Reazioni di terminazione Meccanismo di reazione e spostamento degli elettroni Freccia indicante lo spostamento di un solo elettrone Freccia indicante lo spostamento di una coppia di elettroni Cl Cl CH3 H CH3· hn Cl Cl· Cl· Cl· CH3· Cl CH3Cl + + HCl Cl· H Il raricale CH3· è ibridizzato sp2, planare, 120° C· H H I composti di carbonio in cui atomi di idrogeno sono stati sostituiti con altri più elettronegativi, sono più reattivi. d+ dCH3-Cl CH3Cl + Cl· CH2Cl· + Cl2 CH3Cl + Cl2 CH2Cl· + HCl CH2Cl2 + Cl· CH2Cl2 + HCl CH2Cl2 + Cl2 CHCl3 + HCl CHCl3 + Cl2 CCl4 + HCl le proporzioni tra i prodotti dipendono dal rapporto tra i reagenti -eccesso di metano = monoclorurazione -eccesso di cloro = tetraclorurazione I composti di carbonio in cui atomi di idrogeno sono stati sostituiti con altri più elettronegativi, sono più reattivi. H2C CH2Cl CH 3 CH 2 Cl2 CH2 CH2 CH3 CH3 prodotti di reazione radicali intermedi di reazione CH 3 CH3 CH3 CH Cl CH3 HC prodotto prevalente CH3 stabilità dei radicali CH3 H 3C H2C CH2 HC CH3 CH3 H3C C CH3 CH3 meno stabile più stabile Reattività degli alogenoalcani Gli alogenoalcani, contenendo un legame tra il carbonio ed un elemento molto più elettonegativo, sono molto più reattivi degli alcani. d+ dCH3-Cl Reagenti nucleofili ed elettrofili Nucleofilo = Nu : Ricco di elettroni Nu : S Nu-S Elettrofilo = E E S Avido di elettroni E-S Reagenti nucleofili Ricco di elettroni Nu : S Nu-S Si comportano come nucleofili: • Basi di Arrhenius: OH • Basi di Bronsted: H2O, NH3, ROH, RNH2, R2NH, R3N • Anioni: CN-, CH3O-, CH3COO-, NO2-, NO3SH-, CH3S-, SO42-, F-, Cl-, Br-, I-, etc… Reagenti elettrofili Avido di elettroni E S E-S Si comportano come elettrofili: • Gli H+ degli acidi • Sostanze carenti di elettroni: BCH3, AlCl3, SO3, NO2+, Br+, acidi di Lewis • Cationi: Ag+, Cu2+, Cr3+, ecc… Reazioni di sostituzione nucleofila OH- d+ dCH3 - Cl HO – CH3 CH3-Cl + BrCH -Cl + I- CH3-Br CH3-Cl + SH- CH3-SH CH3-Cl + NO2- CH3-NO2 CH3-Cl + CN- CH3-CN CH3-Cl + CH3O- CH3-OCH3 3 CH3-I CH3-Cl + CH3COO- CH3-OCOCH3 + Cl+ Cl+ Cl+ Cl+ Cl+ Cl- + Cl- Cl- Reazioni di sostituzione nucleofila bimolecolare, Sn2 X- = gruppo uscente HH d+ dC X H energia Nu : dNu H d+H C H dX- HH Nu C H X- Stato di transizione Coordinata di reazione v = k [substrato] [Nu:] Lo stadio lento del meccanismo è l’interazione iniziale tra i reagenti Reazioni di sostituzione nucleofila monomolecolare, Sn1 CH3 CH3 H3C C Cl OH- + H3C C OH + Cl- CH3 CH3 2-metil-2-propanolo 2-cloro-2-metilpropano carbocatione CH3 I°) CH3 H3C C Cl H3C C + Cl- CH3 CH3 II°) CH3 H3C C + CH3 OH- CH3 H3C C OH CH3 v = k [substrato] Lo stadio lento del meccanismo è la formazione del carbocatione Reazioni di sostituzione nucleofila monomolecolare, Sn1 CH3 CH3 energia H3C C Cl H3C C + CH3 CH3 carbocatione CH3 H3C C OH CH3 Coordinata di reazione Il carbocatione è ibridizzato Sp2 Stereochimica delle reazioni di sostituzione nucleofila Sn2 H d+ dH3C C Cl H2C OH- H d+CH3 d- C HO R-2-clorobutano HO CH3 HO H3C solvente Cl C3H7 R-3-cloro-3-metilesano Cl- S-2-butanolo Sn1 C Cl H C CH3 CH2 CH2 CH3 CH3 C2H5 d- H3C C2H5 C CH3 C C2H5 C3H7 S-3-metil-3-esanolo + C3H7 OH- Il carbocatione è ibridizzato Sp2 racemi, racemizzazione H3C C2H5 C OH C3H7 R-3-metil-3-esanolo Fattori strutturali che influenzano le reazioni di sostituzione nucleofila Sn2 reattività R CH3 > R CH2 > R CH >> R C R R Atomi o gruppi ingombranti impediscono l’accesso del nucleofilo Solventi apolari impediscono la formazione del carbocatione Sn1 reattività R R R R C+ C+H > > R C+H2 > R Il carbocatione più sostituito è più stabilizzato Solventi polari favoriscono la stabilizzazione del carbocatione C+H3 Reazione di eliminazione concorrente alla sostituzione nucleofila E2 Quando il carbonio è ingombrato e sono presenti atomi di idrogeno in posizione a, il nucleofilo si può comportare da base e strappare l’idrogeno bimolecolare H H OH- dHO H C C Cl H H H H H C C H2O H H H CH3 C-X > R E1 H CH3 CH-X > CH3 CH2-X R H CH3 C C+ - Cl- H C C Cl H CH3 H etene CH3 monomolecolare Cl- C C cloroetano R H H dCl OH- H CH3 - H2O CH3 H C C H CH3 Alcoli R R CH2-OH Alcol primari R CH-OH R Alcol secondari R C-OH R Alcol terziari Per reazione con il Na danno luogo agli alcolati, buoni nucleofili R-CH2-OH + Na R-CH2-O- Na+ + H2 R-CH2-O- + CH3-Cl R-CH2-O-CH3 + Cl- Alcoli Per reazione con il acidi forti danno luogo ai sali di ossonio, e possono eliminare acqua, buon gruppo uscente. R R R + CH2-O-H | H R - + CH2-O-H | CH3 H Nu : - Nu : H + CH2-O-H | CH2 H + CH-O-H | H R R Nu -CH2 O-H | H CH3 NuH + C-O-H | H CH2 CH2 O-H | H Ossidazione degli alcoli Alcol primari R O || C-H [O] R CH2-OH [O] R Aldeide Alcol secondari R O || C-OH Acido carbossilico R [O] [O] CH-OH C=O R R Chetone Alcol terziari R [O] R R C-OH [O] = ossidante I tioli sono analoghi solforati degli alcoli CH3CH2SH etanotiolo CH3CH2CH2SH 1-propanotiolo CH3 CH3CHCH2CH2SH HSCH2CH2OH 3-metil-1-butanotiolo 2-mercaptoetanolo Sono acidi più forti (pKa = 10) che gli alcoli Non formano legami idrogeno In solventi polari, ioni tiolato sono nucleofili migliori degli ioni alcolato CH3OH Ammine Ammoniaca pKb=4,74 : R NH2 NH Ammine primarie pKb=3,36 R Ammine terziarie pKb=3,36 Le ammine sono dei buoni nucleofili R - NH2 + CH3 - I N: R R Ammine secondarie pKb=3,02 : NH3 R : : R H |+ R - N - CH3 | H + I- : Le ammine e la sostituzione nucleofila CH3 - NH2 + CH3 - I metilammina H |+ CH3 - N - CH3 | H I- + : Dimetilammonio ioduro CH3 - N - CH3 | H + CH3 - I dimetilammina trimetilammina + I- trimetilammonio ioduro : CH3 - N - CH3 | CH3 H |+ CH3 - N - CH3 | CH3 + CH3 - I CH3 |+ CH3 - N - CH3 | CH3 + tetrametilammonio ioduro I- Ossidazione delle ammine Ammine primarie [O] R NH2 R O || C-H Aldeide Ammine terziarie R [O] R N 3 O || C-H R Aldeide R Se l’N è legato ad un carbonio secondario R R [O] CH-NH2 R C=O R Chetone
Scaricare