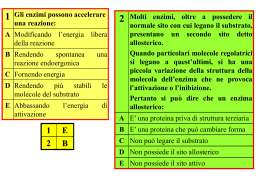
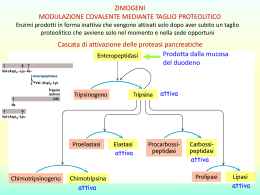
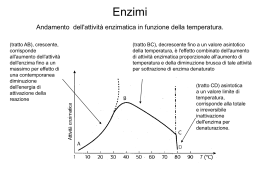
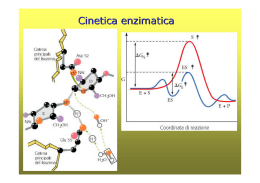
Enzimi = catalizzatori di una reazione biochimica Caratteristiche: •Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre molecole, anche chimicamente simili al substrato. •Saturabilità: quando tutti i siti attivi di tutte le molecole enzimatiche presenti sono legate al substrato (saturate) la velocità di catalisi è massima e non può aumentare ulteriormente, anche aggiungendo altro substrato. •Possibilità di regolazione: la velocità con cui un enzima catalizza una reazione può essere variata in funzione delle necessità della cellula o dell’organismo. (inibizione o attivazione enzimatica) • Gli enzimi riconoscono il loro substrato come una serratura riconosce la chiave Sito regolatore Sito attivo Adattamento indotto Substrato In realtà il legame del substrato è in grado di indurre un cambiamento di conformazione dell’enzima, e in modo particolare del sito attivo, che quindi “si adatta” meglio al legame del substrato Esistono due tipi di inibizione enzimatica: Competitiva = l’inibitore ha una struttura simile al substrato e si inserisce nel sito attivo bloccando l’accesso al substrato Non competitiva = l’inibitore ha una struttura completamente diversa rispetto al substrato e si lega ad un sito regolatore, inducendo un cambiamento di conformazione nell’enzima che quindi non riesce più a legare il substrato Inibitore competitivo Inibitore non competitivo Sito regolatore Sito attivo Cofattori = sono sostanze di natura non proteica che aiutano l’azione degli enzimi Possono essere ioni metallici: (es. Fe, Zn, Cu, Mg, Mn, ecc.) Coenzimi: sono molecole organiche, molto spesso derivati da vitamine idrosolubili. Esempi: •Vit. B1, tiamina (reazioni di decarbossilazione) •Vit B2, riboflavina (FAD: reaz. di ossidoriduzione) •Vit. PP (B3), niacina (NAD, NADP: reaz. di ossidoriduzione) •Vit. B5, acido pantotenico (CoenzimaA, CoA) •Vit. B6, piridossina (transaminazioni) •Vit. B9, acido folico (trasferimento di gruppi di C) •Vit. H, biotina (reazioni di carbossilazione) Cinetica enzimatica Enzima che segue la cinetica di Michaelis-Menten Enzima allosterico (le subunità cooperano come nel caso dell’emoglobina) La velocità di una reazione catalizzata da un enzima aumenta con l’aumentare della concentrazione del substrato, fino ad un punto in cui, pur aumentando il substrato, non aumenta più la velocità → l’enzima è saturato e funziona alla sua velocità massima (Vmax) Se aumentiamo la concentrazione di enzima aumenta anche la Vmax Regolazione enzimatica 1. Da parte di metaboliti intracellulari (es. inibizione a feed-back o attivazione a feed-forward): il prodotto E inibisce l’attività dell’enzima 1 A 1 B 2 C 3 D 4 E X 2. Modifica covalente: es. fosforilazione. L’azione di ormoni come insulina e glucagone induce la fosforilazione o defosforilazione di un enzima attivandolo o inibendolo. ATP Enzima 1 inattivo P ATP Enzima 1 attivo Enzima 2 attivo ADP ADP P Enzima 2 inattivo 3. Variazioni della quantità di enzima (aumento/diminuzione trascrizione mRNA, stabilità della proteina enzimatica) Glucidi = polisaccaridi (amido, glicogeno), disaccaridi (lattosio, saccarosio), monosaccaridi (fruttosio) Lipidi = trigliceridi, colesterolo, fosfolipidi Proteine Sali biliari per la digestione dei lipidi Proteasi •Tripsina •Chimotripsina Lipasi Lattasi Saccarasi Amilasi/destrinasi Peptidasi Sono localizzate sulla superficie degli enterociti Gli enzimi pancreatici sono prodotti come “zimogeni” che sono inattivi. Gli zimogeni vengono trasformati in enzimi attivi mediante taglio proteolitico all’interno del lume intestinale Digestione delle macromolecole nei componenti fondamentali Monosaccaridi, acidi grassi e amminoacidi vengono trasformati in acetilCoA AcetilCoA (2 atomi di C) viene trasfromato in CO2 durante il ciclo dell’acido citrico nei mitocondri. Durante questo processo (di ossidazione) si formano coenzimi ridotti (trasportatori di elettroni). Gli eletrroni vengono trasportati lungo la catena respiratoria fino all’O2 che diventa H2O Questo processo libera l’energia necessaria per la sintesi dell’ATP. ATP fornirà l’energia necessaria per tutti i processi cellulari Glucosio + ossigeno C6H12O6 + 6 O2 Rid. Oss. anidride carbonica + acqua 6 CO2 + 6 H2O Oss. Rid. Energia Reazione di ossidazione del glucosio, si libera una grandissima quantità di energia. Nel nostro organismo introduciamo glucoso (e lipidi) e O2, che vengono trasformati in CO2 e H2O. Nel corso del catabolismo il glucosio (e gli acidi grassi) vengono ossidati ttraverso una serie di tappe successive L’energia che si libera viene conservata sotto forma di “energia chimica” L’energia che deriva da questa trasformazioni viene utilizzata per sintetizzare ATP Durante le reazioni del catabolismo, avvengono una serie di ossidazioni Gli equivalenti riducenti (elettroni) vengono trasferiti su coenzimi ossidati che quindi si riducono 2 e- + 2 H+ NADH + H+ NAD+ 2 e- + 2 H+ FAD FADH2 Ossidato Ridotto NAD = nicotinamide adenina dinucleotide (derivato da niacina, vit PP) FAD = flavina adenina dinucleotide (derivato da ribodfalvina, vit B2) I coenzimi ridotti serviranno per la sintesi di ATP = adenosina trifosfato Questi legami sono ad alta energia ATP = adenosina trifosfato L’ATP viene utilizzato come fonte energetica per tutte le funzioni cellulari: es. •Reazioni di sintesi (es. sintesi proteica, del DNA/RNA, dei lipidi, ecc.) •Contrazione muscolare •Movimento •Trasporto attraverso le membrane Reazioni chimiche: • Esoergoniche o esotermiche (si libera energia, avvengono spontaneamente) • endoergoniche o endotermiche (hanno bisogno di energia dall’esterno per avvenire, non possono avvenire spontaneamente) • di equilibrio (non ci sono grosse variazioni energetiche tra reagenti e prodotti Le reazioni endoergoniche all’interno delle cellule possono avvenire se viene fornita energia, ad esempio mediante la degradazione di ATP Energia A B Energia A B A B ATP ADP+Pi (Energia) A B Controllo del metabolismo • Via metabolica: Es. A B C D E • Tutte le vie metaboliche all’interno di una cellula/organismo sono sottoposte a regolazione • L’attività di alcuni enzimi è regolata da sostanze ad azione inibitoria o attivatoria. Es. inibizione a feedback = E inibisce l’attività dell’enzima che converte A in B • Tutte le vie metaboliche sono sottoposte a regolazione da parte di ormoni che regolano il metabolismo – Insulina – Glucagone – Adrenalina – Ormoni steroidei
Scaricare