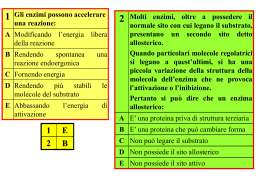
rien ne se perd, rien ne se crée, tout se transforme. Antoine Lavoisier 1743 – 1794 BIOENERGETICA E ENZIMI Capitolo 6: Energia, enzimi e metabolismo H = entalpia: energia totale. H = G + TS G = energia libera di Gibbs: energia utilizzabile per compiere un lavoro S = entropia: disordine del sistema Ad una trasformazione chimica è associata una variazione di energia libera (DG) misurabile : DG = DH - TDS In Biochimica, DG’0 indica la variazione in condizioni standard: - 298 °K (25 °C) - 1 atm. - pH=7 - [ ] =1 M DG < 0 DG > 0 Relazione tra DG e equilibrio di una reazione K’eq= [prodotti] / [substrati] A B K’eq= [B] / [A] DG’0 = - R T lnK’eq R = Costante dei gas = 8, 315 J/(mol * K) T = 298 K Glucosio 1P Glucosio 6P K’eq= [Glucosio 6P] / [Glucosio 1P] = 19 mM / 1 mM = 19 DG’0 = - R T lnK’eq = - (8,315 J/(mole K)) (298 K) ln 19 = - 7,3 kJ/mole Trasformazioni di forme diverse di energia Adenosintrifosfato (ATP) Moneta energetica della cellula Energia di attivazione ENZIMI - Catalizzatori biologici - (quasi) tutti gli enzimi sono proteine - Sono altamente specifici - Permettono lo svolgersi di reazioni in condizioni fisiologiche - Agiscono abbassando l’energia di attivazione Abbassamento dell’energia di attivazione nella catalisi enzimatica Meccanismi per l’abbassamento dell’enegia di attivazione Orientamento dei substrati Destabilizzazione del substrato Modificazioni chimiche Specificità e complesso enzima-substrato S+E → ES → P+E Effetto della concentrazione del substrato S+E → ES → P+E Cinetica di Michaelis-Menten KM = Concentrazione di substrato alla quale si ha metà della Vmax Nomenclatura degli enzimi Nomi degli enzimi sono basati su: - reagenti / prodotti - tipo di reazione - si aggiunge il suffisso “-asi” Esempi: Peptidasi idrolizza i legami peptidici Piruvato decarbossilasi rimuove un gruppo carbossilico dal piruvato Classificazione ufficiale degli enzimi 1) 2) 3) 4) 5) 6) Ossidoreduttasi Transferasi Idrolasi Liasi Isomerasi Ligasi – reazioni redox – trasferimento di gruppi – reazioni di idrolisi – traserimento di gruppi su doppi legami – reazioni di isomerizzazione – formazione di legami con uso di ATP Ad ogni enzima viene assegnato un numero a 4 cifre dalla Enzyme Commission Gli enzimi possono utilizzare - cofattori (metalli) - coenzimi (molecole complesse) Effetto della temperatura sull’attività dell’enzima Effetto del pH sull’attività dell’enzima Proteasi del virus dell’HIV con molecola di inibitore
Scaricare