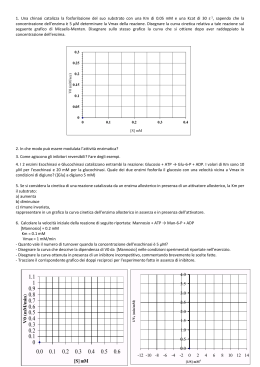
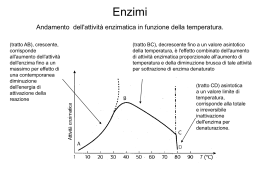
ENZIMI Il termine catalizzatore, mutuato dalla chimica, si riferisce ad una sostanza che aumenta la velocità di una reazione chimica, pur non facendo parte della equazione che la definisce e che si ritrova inalterato al termine del processo. Un enzima è un catalizzatore biologico: aumenta la velocità di una reazione, ma non provoca alcuna trasformazione che non sarebbe accaduta in sua assenza, sia pure in tempi più prolungati, cioè non sposta l’equilibrio di una reazione ma abbrevia il tempo in cui esso viene raggiunto. Approfondimento Nelle reazioni chimiche, come in tutto il mondo fisico, non è possibile creare o distruggere energia. Un sistema può perdere o guadagnare energia come calore o compiere lavoro a spese dell’intorno (ambiente). Per un cambiamento di stato, la I legge della termodinamica può essere espressa dalla seguente equazione: ΔE = q – w (1) dove ΔE rappresenta la variazione di energia interna del sistema; q il flusso di calore e w il lavoro compiuto. Per piccole variazioni differenziali di ha: dE = dq – dw (2) Se il lavoro compiuto implica variazioni nel volume del sistema ad una data pressione, il termine dw diventa PdV (dove P è la pressione e V il volume) e la eq. (2) diventerà: dE = dq – PdV (3) L’energia interna di un composto è rappresentata dall’entalpia (H). In questo termine sono contenute sia l’energia derivante dalle interazioni tra le molecole sia quella intrinseca delle molecole stesse. La relazione che lega la variazione di entalpia e la variazione dell’energia interna del sistema è espressa dalla seguente equazione: ΔH = ΔE – PΔV (4) Per piccole variazioni si avrà: dH = d(E + PV) = dE + PdV + VdP (5) ed anche : dH = dq – dw + PdV + VdP (6) Per un sistema che compie esclusivamente lavoro di tipo PdV (cioè dw = PdV) si avrà: dH = dq + VdP (7) Per reazioni che avvengono a pressione e volume costanti, come la maggior parte delle reazioni biochimiche, si avrà che: dH= dq (8) Una reazione tenderà ad avvenire con più facilità tanto più negativo sarà il termine: ΔH - TΔS (9) cioè fino a quando ΔG = 0. In queste condizioni non viene svolto lavoro termodinamico ed il sistema ha raggiunto l’equilibrio. Biochimica ed Energia Anche se nell'universo tutto tende spontaneamente verso il massimo disordine (ΔS>0) ciò non comporta la possibilità di utilizzare la variazione di entropia per potere misurare la spontaneità di un processo; ciò in quanto non é possibile misurare l'entropia dell'intero universo. Quanto affermato spiega perché non è possibile predire la spontaneità di una qualunque trasformazione soltanto dalla misurazione della variazione dell' entropia; infatti una reazione esotermica (ΔH<0) può avvenire spontaneamente anche se è caratterizzata da una diminuzione di entropia (ΔS<0). Pensiamo ad esempio ad una proteina denaturata che in particolari condizioni tende spontaneamente a riavvolgersi assumendo la conformazione nativa altamente ordinata, che le conferisce attività biologica. Ed allora quale é la funzione di stato che ci può permettere di capire se un processo é spontaneo o meno? Questa, per sistemi che lavorano a P e a V costanti, é la variazione di energia libera (ΔG) che è uguale alla variazione di entalpia (ΔH) meno la variazione di entropia (ΔS): ΔG = ΔH - TΔS ed essendo per processi spontanei che avvengono a temperatura costante: TΔ S ≥ qp dove qp rappresenta la quantità di calore trasferita (dissipata) a T=K. Il criterio di spontaneità per processi quali quelli biochimici (T e P costanti) é dato da un ΔG ≤ 0. Quando un sistema a T e P = K non effettua alcun lavoro dipendente da P e V è possibile inserire nella relazione che lega la variazione dell'energia libera al calore dissipato ed alla variazione di entropia ed al lavoro, per cui l'equazione precedente diventerà: e poiché ΔG = qp - TΔS - w' (w'= lavoro) TΔS ≥ q, ΔG = ≤ - w' ovvero ΔG = ≥ w' da cui si evince che: in un sistema biologico (dove il lavoro dipendente da variazioni di P e V è assolutamente insignificante) il Δ G di un processo rappresenta il massimo lavoro ottenibile; da cui: il lavoro e quindi l'energia immessa in un qualunque sistema, non può essere recuperato completamente. Questo é indicativo dell'intrinseco carattere dissipativo della natura. L'energia libera di Gibbs é la funzione termodinamica più importante usata in biochimica. Per ogni processo reale o fattibile, la variazione dell'energia libera di Gibbs (Δ G) é negativa; il sistema possiede più energia libera nello stadio iniziale che in quello finale. Δ G = Gfinale – Giniziale, Tutte le reazioni fattibili si svolgono con variazioni negative di energia libera (ΔG). Quando la variazione di energia libera é zero, la reazione o processo è all'equilibrio. Questi importanti risultati possono essere così sintetizzati: ΔG < 0 (il processo é fattibile ed esoergonico) ΔG = 0 (prevalgano condizioni di equilibrio ed il processo è isoergonico) ΔG > 0 (il processo non è fattibile ed è endoergonico) Da quanto detto si potrebbe dedurre che qualunque reazione con un valore di ΔG altamente negativo deve procedere con una velocità misurabile, ma così non è dipendendo essa dal ΔG di ogni singolo intermedio della reazione. Ciò significa che anche se il ΔG complessivo é altamente negativo la trasformazione di un substrato in un prodotto potrebbe presentare degli intermedi con ΔG positivi. Ecco perché molte trasformazioni di per se termodinamicamente favorite necessitano per avvenire, a velocità misurabili, della presenza di specifici enzimi che accelerano la reazione senza però interferire sul ΔG complessivo della trasformazione. Ne deriva che un enzima può soltanto accelerare il raggiungimento dell'equilibrio termodinamico ma non può promuovere un reazione che presenta un ΔG positivo. In una qualunque reazione di trasformazione (S → P) viene immediato pensare che maggiore è il rapporto S/P maggiore sarà la possibilità di fare avvenire la trasformazione, se tale reazione mostra ΔG negativi. Al contrario se il rapporto S/P è identico al rapporto all’equilibrio (P/S = Keq) non avverrà nessuna trasformazione e non verrà svolto alcun lavoro (ΔG = 0). Variazione di energia libera standard e costante di equilibrio La variazione di energia libera standard è correlata alla costante di equilibrio. Consideriamo la seguente chimica: A+B→C+D L'equazione seguente illustra la relazione logaritmica tra la variazione di energia libera standard e la costante di equilibrio: ΔG0 = -RT ln Keq dove R è detta costante dei gas o coefficiente energia-temperatura e mette appunto in relazione la temperatura con l'energia. R ha il valore di 8.314 KJ mole-1 o 1.987 Kcal mole-1, e T è il valore della temperatura assoluta in gradi Kelvin (25 °C = 298 °K). E' necessario a tal punto definire le condizioni standard per il biochimico. Dato che la maggior parte delle reazioni biochimiche avviene in soluzioni acquose, la concentrazione dei reagenti e dei prodotti può essere assunta uguale ad 1M (1 mole/litro). Il fatto che l'acqua in realtà non abbia una concentrazione 1M ma bensì 55.6 M (l000g/L+18g/mole acqua) non ha comunque effetto auJIe variazioni di energia libera. Per ricapitolare, "la variazione di energia libera standard di un processo chimico è la variazione_ di energia libera di Gibbs durante la conversione dei reagenti in prodotti di tutti i componenti (eccetto l’acqua) sono presenti ad una concentrazione 1M". La concentrazione dei componenti rimane costante durante la conversione. La variazione di energia libera di molte reazioni è influenzata dal pH. Siccome la maggior parte delle reazioni biochimiche avviene in condizioni vicine alla neutralità (pH=7), questo valore di pH (H+ = 1•10-7) è usato per lo standard biochimico. Questo perché una concentrazione 1M di H+ corrisponderebbe ad un pH ≈ 0 incompatibile con la vita. Questa convenzione è indicata dal simbolo (‘) ed indicheremo ΔG come ΔG', ΔG0 come ΔG0’ e Keq come K'eq. Anche in questo caso la variazione di energia libera standard sarà funzione logaritmica della costante di equilibrio: ΔG0’ = -RT In K'eq (dove RT = 2477.6 J mole-1 a 25 °C) che se espressa in forma di logaritmo decimale sarà: ΔG0' = -2.3 RT lg K'eq (dove 2,3 RT = 5698.4 J mole-1 a 25 °C) La relazione matematica che lega ΔG' ad una qualunque reazione deve contenere due termini: uno che contiene la concentrazione dei substrati e dei prodotti nelle varie fasi di trasformazione ed l'altro la concentrazione degli stessi all'equilibrio: ΔG' = -1,3 RT Iog K'eq + 2,3 RT log [P]a [P]b…../[S]c [S]d... Per cui la variazione di energia libera qualunque sia la concentrazione dei reagenti e dei prodotti: ΔG' = ΔG0’ + 5968.4 1og [P]a[P]b…../[S]c [S]d... Il concetto della addizionabilità dei singoli valori di ΔG' in una trasformazione complessa permette ai sistemi biologici di produrre l’energia necessaria a portare avanti tutte la reazioni chimiche necessarie per la propria crescita e sopravvivenza. L'energia non essendo sempre immediatamente utilizzabile, o se si, non utilizzabile nello stesso compartimento cellulare, deve essere immagazzinata in una qualche forma che possa essere disponibile quando necessario (glicogeno, trigliceridi, proteine) sia immediatamente disponibile (creatina-P, ATP, ed in percentuale inferiore altri nucleotidi quali UTP, CTP, GTP, NADH e NAPH). _________________________ Come già descritto l’equazione che definisce la variazione di energia libera di una reazione chimica contiene due termini: uno che indica la concentrazione dei prodotti e dei reagenti in condizioni di equilibrio ed uno che indica le reali concentrazioni dei prodotti e dei reagenti in un determinato sistema. Se si considera la reazione: A+B ↔ C+D Varrà la seguente equazione: dove ΔG’ è la variazione di energia libera del sistema a pH 7.0 e ΔG 0’ esprime la variazione di energia libera nelle seguenti condizioni standard: 1. concentrazione 1M di tutti i ragenti e dei prodotti; 2. pressione pari ad 1 atmosfera; 3. temperatura di 25 °C; 4. pH 7.0. Un valore negativo di ΔG’ indica che una reazione come quella sopra scritta procederà da sinistra verso destra e, in determinate condizioni di concentrazione di reagenti e prodotti, dà una misura di quanto la reazione considerata sia lontana dall’equilibrio (Figura). Tuttavia il parametro ΔG’ non dà alcuna indicazione sulla velocità con cui la reazione si avvicina all’equilibrio. Quando una reazione è all’equilibrio, indipendentemente dalle concentrazioni iniziali di A, B, C, D, si verificano le condizioni di minima energia in cui non è possibile alcun lavoro ulteriore, cioè: ΔG’ = 0 Poiché le concentrazioni indicate si riferiscono all’equilibrio, si ha che: Come un valore di ΔG’ molto negativo non implica che una reazione proceda ad alta velocità, ma semplicemente che il rapporto esistente tra prodotto e reagenti è più basso che all’equilibrio, così un valore di ΔG°’ molto negativo, che pure indica la tendenza di una reazione a procedere verso destra, non dice nulla sulla velocità alla quale la reazione procede. Gran parte delle reazioni con ΔG°’ molto negativo non procedono a velocità apprezzabile a temperatura compatibili con la vita in assenza di un opportuno catalizzatore. Per esempio l’ossidazione completa del glucosio: glucosio + 6O2 → 6CO2 + 6H2O ha un ΔG°’ di –686 kcal/mole, conseguentemente il glucosio all’aria è piuttosto instabile in senso termodinamico. Ma il glucosio come cristallo solido in ambiente sterile ed a temperatura ambiente non produce CO2 ed H2O ad una velocità misurabile, per cui il glucosio è stabile in senso cinetico. La stabilità cinetica si spiega considerando un tipico profilo energetico, cioè un grafico in cui viene riportata la variazione di energia libera standard in funzione della coordinata di reazione (Figura). Considerando una qualsiasi reazione: S → P La velocità di questa reazione dipende dal numero di molecole di S che entrano nello stato di transizione per unità di tempo. Infatti per aumentare la velocità di una reazione si può innalzare la temperatura del sistema che, aumentando il moto termico delle molecole, incrementa il numero di molecole S attivate, oppure abbassare l’energia di attivazione della reazione, cosa che si ottiene con l’intervento di un catalizzatore. Una reazione elementare, o reazione a uno stadio, è contraddistinta da una sola energia di attivazione e da un solo stato di transizione (vedi Fig. precedente), mentre in una reazione a più stadi ci sono una energia di attivazione e uno stato di transizione per ogni stadio (vedi Figura seguente). Le cellule vivono a temperature relativamente basse (0-100 °C). A queste temperature poche reazioni, se non nessuna, avverrebbero ad una velocità sufficiente da consentire alla cellula di crescere e di riprodursi. I sistemi biologici sono in grado di sopravvivere in condizioni “blande” in senso biochimico, in quanto utilizzano catalizzatori biologici, gli enzimi, che selettivamente abbassano l’energia di attivazione delle reazioni cicliche vitali. Una reazione catalizzata da un enzima a 25 °C può procedere da 106 a 1015 volte più velocemente della stessa reazione non catalizzata. Come già detto, l’enzima non ha alcun effetto sulla variazione di energia libera e sulla costante di equilibrio della reazione, semplicemente aumenta la velocità con la quale la reazione raggiunge l’equilibrio. Consideriamo la seguente trasformazione: k1 S ⇔ P (k1 = 10-3 min-1 e k-1 = 10-5 min-1) k-1 dove le due k sono rispettivamente le costanti di velocità delle reazioni S → P e P → S. All’equilibrio, la velocità della reazione (v) in un senso eguaglia quella nell’altro senso: v1 = k1[S] = v-1 = k-1[P] cioè: k1[S] = k-1[P] da cui: [P] = k1[S]/k-1 poiché: Keq = [P]/[S] avremo che: Keq = k1/k-1 = 10-3/10-5 = 100 In presenza di un opportuno enzima sia k1 che k-1 sono aumentate nella stessa misura. Dunque Keq rimane invariata e di conseguenza anche ΔG’ e ΔG°’. L’energia di attivazione viene abbassata nelle reazioni catalizzate. ΔG è l’energia di attivazione della molecola dello stato di transizione e ΔG° è l’energia libera totale della reazione. ‡ Definizione di Enzima Enzimi: 1. Gli enzimi sono catalizzatori sintetizzati nelle cellule; 2. Chimicamente sono polimeri eterologhi di aminoacidi (proteine); 3. spesso sono associati a cofattori per svolgere la loro attività catalitica. 4. L’enzima può essere costituito da un solo polipeptide (monomero) o da più polipeptidi (oligomero). L’oligomero può essere costituito da monomeri (detti anche subunità) identici (portomeli) o da monomeri diversi. Gli enzimi possono essere classificati sulla base della natura chimica del cofattore a cui sono associati per essere biologicamente attivi. I cofattori o coenzimi si distinguono in: Ioni metallici (Ca2+, Zn2+, Mg2+, K+, ecc.). Fanno parte del sito attivo partecipando direttamente al meccanismo di catalisi. Coenzimi trasportatori. Molecole organiche che si legano reversibilmente con legami deboli all’apoenzima e partecipano al meccanismo di catalisi. Sono trasportatori di radicali: atomi o gruppi di atomi (es. NAD+, CoA….). Avvenuta la reazione un prodotto della reazione rimane legato al coenzima, il coenzima quindi diffonde e si lega ad un altro enzima per cedere in un’altra reazione il radicale trasportato. Gruppi prostetici. Molecole organiche legate stabilmente all’apoenzima mediante legami covalenti o molti legami deboli (es. citocromi, biotina….). I cofattori svolgono un ruolo fondamentale nella catalisi; in loro assenza l’enzima non è attivo; la reattività dei cofattori è influenzata dalla proteina, senza apoenzima essi sono inattivi per la catalisi. Esistono casi in cui ioni metallici o molecole (talvolta coenzimi stessi) sono indispensabili per l’attività di un enzima pur non partecipando direttamente al meccanismo della catalisi. Essi servono a mantenere l’enzima nella conformazione attiva e possono essere legati stabilmente o reversibilmente alla proteina, in questo ultimo caso possono agire come effettori per la regolazione dell’enzima. PRINCIPALI COENZIMI E GRUPI PROSTETICI Nicotinamide adenin dinucleotide (NAD+) e Nicotinamide adenin dinucleotide fosfato (NADP+) ↑ Nella forma ridotta è indicata solo la nicotinamide (vitamina PP) ed R rappresenta il resto della molecola. La freccia indica l’ossidrile esterificato con acido fosforico nel NADP+. I due coenzimi piridinici hanno diversa funzione: il NADH cede 1H+ e 2 e- per la sintesi di ATP; Il NADPH cede 1H+ e 2e- per le reazioni di riduzione nei processi di biosintesi (anabolismo). Il NADP+ ed il NAD+ quando vengono ridotti in una reazione, si liberano della parte proteica dell’enzima, diffondono per legarsi ad un’altra proteina enzimatica e partecipare ad una reazione di riduzione in cui cedendo 1H+ e 2e- sono nuovamente riossidati; quindi diffondono per legarsi al primo enzima ed essere di nuovo ridotti. I NAD+ vengono ridotti in varie reazioni; nella glicolisi: 3-fosfogliceraldeidedeidrogenasi; nel ciclo di Krebs: isocitrico deidrogenasi, lipoil deidrogenasi, malico deidrogenasi, ecc. I NADH + H+ vengono ossidati nella fosforilazione ossidativi, nella gluconeogenesi (3-fosfogliceraldeide-deidrogenasi) nella glicolisi anaerobia (LDH). I NADP+ vengono ridotti nello shunt dell’esosomonofosfato, e nelle reazioni dell’enzima malico e dell’isocitrico deidrogenasi. I NADPH + H+ vengono ossidati nella sintesi degli acidi grassi, sintesi dell’acido tetraidrofolico, colesterolo ecc. Coenzima A(CoA), trasportatore universale di gruppi acili. Principali vie metaboliche dove viene utilizzato il CoA: β-ossidazione degli acidi grassi, prime reazioni per la sintesi del colesterolo e corpi che tonici, sintesi dei trigliceridi e fosfolipidi, allungamento della catena alifatica dell’acido palmitico. Struttura della Vitamina B1 e sua forma attiva fosforilata Struttura della Vitamina B2 (Riboflavina) e forme attive La riboflavina, isolata per la prima volta dal latte, deve il suo intenso colore giallo al complesso anello di isoallosazina presente nella molecola. La dose giornaliera consigliata nella dieta è di circa 1,7 mg. Le forme coenzimatiche attive della riboflavina sono due: 1. FMN (riboflavina-5’-P) 2. FAD (flavinadenindinucleotide) Proprietà dell’Enzima L’enzima è un congegno chimico le cui proprietà di catalisi specifica sono ristrette ad una piccola zona della superficie della molecola, detta sito catalitico. Il sito catalitico ha le seguenti proprietà: 1. Complementarietà di carica e di forma con il substrato che lega con alta affinità e specificità. 2. Parte della sua struttura può essere idrofoba. In questa parte si hanno forti interazioni tra atomi carichi elettrostaticamente che non sarebbero possibili in presenza di acqua (es. gruppi carbossilici indissociati, legami salini molto forti). Essa inoltre serve a legare le parti idrofobiche (quando presenti) dei substrati. 3. Possibilità di piccoli spostamenti (da 0 a 2 Å) tra i gruppi responsabili della formazione del complesso ES e/o della catalisi. Questi spostamenti sono causati da cambiamenti conformazionali dell’enzima che ha legato il substrato (induced fit) o effettori (allosterismo)). I cambiamenti conformazionali, facilmente reversibili perché richiedono poca energia fornita dall’agitazione molecolare, sono parte essenziale dei meccanismi molecolari di catalisi e di regolazione degli enzimi. 4. La geometria (naturale o indotta) dei gruppi responsabili della legatura del substrato e della catalisi è tale da porre gli atomi (dei substrati e dell’enzima) che devono interagire nella distanza e nell’angolo che devono formare (effetti prossimità ed orientamento degli orbitali) e se necessario provocare una distorsione nella struttura del substrato. GRADI DI SPECIFICITA’ Un enzima ha specificità assoluta quando lega un solo substrato (es. aspartasi, glucochinasi, succinico deidrogenasi) o relativa quando può legare vari composti in genere aventi struttura chimica simile catalizzando lo stesso tipo di reazione (es. esochinasi, lipasi, esterasi, fosfatasi) o catalizzando anche reazioni diverse (es. la chimotripsina lega substrati diversi e catalizza reazioni diverse come la scissione idrolitica del legame peptidico, amidico ed estereo). L’aspartasi è un esempio di enzima dotato di specificità assoluta, di stereospecificità e di specificità geometrica. Questo enzima catalizza la trasformazione dell’acido L aspartico in acido fumarico: questo riconoscimento (stereospecificità) è solo apparentemente di difficile realizzazione, infatti, se si ammette che l’enzima prenda contatto con il substrato in almeno tre punti (es. i due gruppi COO- e il gruppo NH+3) e tenendo presente la disposizione nello spazio di tali gruppi si comprende il perché della incapacità della aspartasi di attaccare il D-aspartato. Specificità relativa: composti simili sono substrati dell’enzima, ma con diversa Km e Vmax. Ciò può essere causato da una diversa affinità di E verso i vari substrati e/o perché i substrati sono più o meno chimicamente idonei ad indurre la conformazione richiesta per la catalisi(Induced Fit). Le lipasi sono enzimi con specificità relativa, scindono idroliticamente il legame estereo tra il carbossile di vari acidi grassi con vari alcool. Le <<vere lipasi>> scindono il legame estereo tra acidi grassi a lunga catena ed il glicerolo. Le fosfatasi monoesterasi scindono idroliticamente il legame estereo dell’acido fosforico con qualsiasi molecola biologica. Legatura del substrato all’enzima e catalisi. <Teoria dell’Induced Fit> La legatura di E con S e la catalisi sono eventi separati e concatenati; responsabili di queste due fasi della funzione catalitica degli enzimi sono in genere catene laterali di differenti aminoacidi tutte localizzate nel sito attivo dell’enzima. La specializzazione nelle due funzioni di residui aminoacidici diversi è richiesta dal meccanismo dell’induced-fit (teoria della conformazione indotta dal ligando sul sito catalitico dell’enzima), dove i residui aminoacidici responsabili della catalisi interagiscono con il substrato solo dopo che questo si è legato al sito catalitico. Una prova della separazione delle due funzioni è data dalla inibizione competitiva (analoghi del substrato si legano all’enzima, talvolta più stabilmente del substrato stesso, ma non reagiscono perché non possono interagire in maniera opportuna con i gruppi dell’enzima responsabili della catalisi. CATALISI ENZIMATICA I -MODI DI SCISSIONE DEI LEGAMI DA PARTE DEGLI ENZIMIUn legame covalente tra due atomi consiste nella condivisione di una coppia di elettroni. Nella scissione di un legame, uno o entrambi gli atomi si combinano con nuovi atomi con cui condividono una coppia di elettroni. Consideriamo ad esempio la scissione del legame C-H. Il processo può avvenire soltanto in due modi: (1) Scissione omolitica (omolisi) in cui un elettrone rimane sul carbonio ed uno sull'idrogeno con formazione di due radicali; cioè di specie che presentano un elettrone spaiato distribuito sugli orbitali molecolari -C÷H → -C•+ H• un altro esempio di reazione a radicali liberi, anche se completamente diversa è quella che coinvolge l'O2 e il Fe2+ dell'eme emoglobinico Fe2+÷O=O → Fe2+ + O=O C'è una probabilità finita e piccola che avvenga la seguente reazione collaterale, con la produzione del radicale libero superossido Fe2+÷O=O → Fe3+ * O=O•L'emoglobina risultante è detta metaemoglobina che può essere riconvertita in emoglobina ferrosa; anche lo ione superossido può essere eliminato (2) Scissione eterolitica (eterolisi), che lascia entrambi gli elettroni su un atomo; se rimangono sul carbonio si forma una specie intermedia detta carbanione più un H+ −C÷H → −C•-+ H+ se rimangono sull'idrogeno si formano un carbocatione, che è una specie elettroncarente, e uno ione idruro −C÷H → −C++ H•I carbocationi e gli ioni idruro sono specie intermedie in molte reazioni catalizzate dalle deidrogenasi La formazione di un carbanione è generalmente più favorita, essendo il carbonio più elettronegativo dell'idrogeno ma, nelle reazioni enzimatiche, può anche generarsi l'altro meccanismo che viene determinato dai costituenti del sito attivo. Le vie di scissione eterolitiche coinvolgono intermedi ionici che si formano nella conversione del substrato/i in prodotto/i. Una grossolana classificazione dei reagenti in base alle loro caratteristiche consiste nella loro divisione in elettron-ricchi (nucleofili) o elettron-carenti (elettrofili). I nucleofili più comuni in biologia sono quelle molecole che contengono ossigeno, zolfo e azoto, per es.: H-O-H, R-O-H, R-O-, R-S-H, R-S-, R=N-H Gli elettrofili di importanza biologica disponibili per i numerosi nucleofili, sui substrati o nei siti attivi degli enzimi sono, al contrario, pochi. Questi spesso sono cationi metallici come Cu2+, Fe2+, Fe3+, Mo6+, Zn2+, protoni (H+), oppure atomi che hanno un guscio elettronico di valenza non completamente riempito, e alcuni cofattori come i derivati delle vitamine B1 e B6. II -MODI DI AUMENTO DELLA VELOCITA' DI SCISSIONE DEI LEGAMII meccanismi con i quali gli enzimi aumentano la velocità delle reazioni chimiche possono essere classificati in quattro gruppi: - Facilitazione per effetto di prossimità - Catalisi covalente - Catalisi acido-base generale - Tensione, distorsione molecolare e cambiamento di forma Effetto prossimità Questo effetto, anche detto effetto di vicinanza, sta ad indicare che la velocità di reazione tra due molecole viene innalzata se esse vengono sottratte dalla soluzione diluita e portate in vicinanza l'una con l'altra nel sito attivo dell'enzima; ciò aumenta la concentrazione effettiva dei reagenti. Catalisi covalente In questo tipo di meccanismo sono coinvolte le catene laterali di aminoacidi, che presentano un certo numero di gruppi nucleofili: R-COO-, R-NH2, aromatico-OH, istidile, R-OH, R-S- Questi gruppi attaccano le parti elettrofile (elettron-carenti) dei substrati per formare un legame covalente tra il substrato e l'enzima, formando così un intermedio di reazione. Questo tipo di processo è particolarmente evidente negli enzimi che trasferiscono gruppi (transferasi, classe EC 2). Nella formazione di un intermedio legato covalentemente, l'attacco da parte del nucleofilo enzimatico al substrato può produrre acilazione, fosforilazione o glicosilazione del nucleofilo. Catalisi acido-basica generale La catalisi acido-basica altro non è che il processo di trasferimento di un protone nello stato di transizione. Di per se essa non causa formazione di legami covalenti, ma una reazione enzimatica può anche implicare ciò nella sua globalità . L’esempio di catalisi acido-basica generale sotto riportata illustra il concetto appena menzionato. Reazione globale: Meccanismo di reazione A: Una base (OH-) accelera la formazione del semiacetale nel modo seguente: Nota: L’OH- è riciclato nella reazione e può quindi essere considerato un catalizzatore nel vero senso della parola. Meccanismo di reazione B: La reazione avviene anche con catalisi acida, che implica la formazione di un sale di ossonio, seguita dalla reazione con l’alcool, nel modo seguente: Nell’esempio precedente, la velocità di formazione del semiacetale viene innalzata in acido forte o in base forte. In altri casi soltanto uno dei due, o la base o l’acido, può agire da catalizzatore. La catalisi acido-basica può aumentare la velocità di una reazione al massimo di 100 volte, ma insieme ad altri meccanismi che operano nel sito attivo di un enzima contribuisce considerevolmente all'aumento della velocità della reazione enzimatica. La forma protonata delle catene laterali aminoacidiche di acido glutamico, istidina, acido aspartico, lisina, tirosina e cisteina possono agire da catalizzatori acidi e nella forma non protonata da catalizzatori basici. E' ovvio che il tipo di catalisi effettivamente svolta dipenderà dal pKa nell'ambiente del sito attivo e dal pH a cui agisce l'enzima. Tensione, distorsione e cambiamenti di forma La tensione nel sistema di legami dei reagenti, ed il rilascio della tensione nel momento in cui lo stato di transizione si converte in prodotti (ad es. il taglio di una molla compressa) può provocare un aumento della velocità di reazione. Le due seguenti reazioni chimiche implicano l’idrolisi di un legame di un estere fosforico. In condizioni standard, la reazione (a) e 108 volte più veloce della reazione (b). Ciò si spiega col fatto che il composto ciclico in (a) ha una considerevole tensione di legame (l’energia potenziale in questa configurazione è alta), che viene rilasciata con l’apertura dell’anello durante l’idrolisi. Questo tipo di tensione non è presente nel di estere in (b). Nel caso della catalisi mediata da un enzima, non soltanto può essere distorto il substrato, ma anche l'enzima con tutte le sue catene laterali aminoacidiche. Per cui il legame di un substrato ad un enzima coinvolge un'energia di interazione, che può facilitare la catalisi. L'aumento della velocità di catalisi deve anche prevedere una destabilizzazione globale del complesso enzima-substrato ed un aumento di stabilità dello stato di transizione. La destabilizzazione del complesso ES è dovuta alla distorsione degli angoli di legame e dei legami stessi. Nella destabilizzazione potrebbe essere pure coinvolta la desolvatazione di un gruppo carico attivo in un sito idrofobico. CINETICA ENZIMATICA La cinetica enzimatica è quella branca dell'enzimologia che studia le modalità di azione di tutti i fattori che influenzano la velocità di catalisi enzimatica. I più importanti sono: a) la concentrazione dell'enzima; b) la concentrazione del ligando (substrati, prodotti, inibitori e attivatori); Ad esempio variando le concentrazioni dei substrati e dei prodotti è possibile dedurre il meccanismo cinetico della reazione, cioè in che ordine i substrati entrano ed i prodotti escono e se questo ordine e libero o obbligato. E' possibile stabilire i tipi di complessi ES ed EP che si possono formare ed in alcuni casi ci può dare informazioni sulla stabilità degli intermedi legati covalentemente all'enzima e non dosabili con i normali metodi di chimica analitica. E' possibile determinare i valori delle costanti cinetiche e, conoscendo le normali concentrazioni intra cellulari dei substrati, avere un'idea sull'andamento fisiologico della reazione. La cinetica di una reazione ci può indicare il modo con il quale l'attività di un enzima può essere regolata in vivo. La analisi cinetica ci può condurre alla definizione di un modello per una reazione catalizzata da un'enzima e viceversa i principi di cinetica enzimatica possono essere usati per scrivere le equazioni di velocità per un modello, che può essere testato sperimentalmente. c) il pH; d) la concentrazione ionica; e) la temperatura. La temperatura può influenzare la velocità di una reazione catalitica Per valori di temperatura sino a 20 °C normalmente l’attività dell’enzima è sfavorita dalla eccessiva rigidità della struttura, dal basso grado di ionizzazione dei gruppi catalitici del sito attivo e dalla bassa energia cinetica delle molecole di substrato. Per temperature superiori ai 40-50 °C si può evidenziare una diminuita attività biologica dovuta alla instabilità della struttura proteica ed alla eccessiva energia cinetica dei substrati. A temperature superiori si potrà verificare la completa in attivazione per denaturazione. Ogni enzima è comunque caratterizzato da un valore di temperatura ottimale di funzionamento che è dovuto alla sua struttura ed ai gruppi catalitici che caratterizzano il sito catalitico. Per calcolare il valore di temperatura ottimale può essere utilizzata l’equazione di Arrhenius Equazione di Arrhenius ed energia di attivazione La relazione esistente tra la costante di velocità della reazione, k, e l’energia di attivazione, E, è data dalla equazione di Arrhenius k = Ae-E/RT che può essere espressa in forma logaritmica: log k = -[(E/2.3 RT) 1/T] + log A dove A è una costante per la particolare reazione. In un semplica sistema in rapido equilibrio, Vmax/[E]t= Kp (Kcat) (Kcat costante di velocità di primo ordine) Il plott di log Vmax o log Kcat vs 1/T, permette di calcolare E (energia di attivazione della tappa catalitica) Le costanti termodinamiche ΔG0, ΔH0 e ΔS0 relative al legame tra il substrato e l’enzima possono essere anch’esse calcolate una volta calcolata la costante di legame Ka (Ka=1/Ks). ΔG0 può essere ottenuta dalla seguente equazione ΔG0 = -RTlnKa se Ka è misurata a due o più valori di temperatura, il plot di lnKa vs 1/T, conosciuto come plot di van’t Hoff, darà una retta la cui pendenza sarà -ΔH0/R e la cui intercetta sull’asse delle y sarà ΔS0/R grazie alla relazione: lnKa = (ΔS0/R) – (ΔH0/RT) Quando questi fattori sono analizzati propriamente è possibile chiarire notevolmente la natura della reazione catalizzata dall'enzima. In particolare, uno studio degli effetti della variazione del pH e della temperatura, sull'attività dell'enzima, ci può dare informazioni sui residui aminoacidici presenti nel sito attivo. TEORIA DEL RAPIDO EQUILIBRIO (HENRI, MICHAELIS e MENTEN) La più semplice reazione di catalisi enzimatica coinvolge un singolo substrato e da un singolo prodotto. Un sistema del genere è chiamato, secondo la nomenclatura di Cleland Uni Uni. K1 K2 K3 E + S ⇔ ES ⇔ EP ⇔ E + P K1 K-2 K-3 dove ES e EP sono chiamati complessi centrali. Per semplicità , assumiamo che esiste un singolo complesso centrale e che la reazione inversa sia tanto bassa da non essere considerata. K1 Kp E + S ⇔ ES → P K-1 In condizioni di equilibrio rapido la velocità istantanea dipende dalla concentrazione di ES: v = kp[ES] dove kp è una costante di velocità catalitica. La concentrazione totale di enzima [Et] è distribuita tra E ed ES per cui [Et] = [E]+[ES] Dividendo entrambi i membri dell'equazione di velocità per [Et] avremo: v/[Et] = kp[ES]/ [E]+[ES] (1) Trovandoci alle condizioni d'equilibrio avremo che Ks=[E][S]/[ES]=k-1/k1; [ES]= [S]/Ks [E] e sostituendo nella (1) da cui se quando tutto l’enzima è legato: v = kp[ES] [Et] = [ES] avremo che : kp[Et]= Vmax dove Vmax rappresenta la massima velocità catalitica osservabile quando tutto l’enzima è legato, e l’equazione (3) diventerà: L’equazione di Michaelis e Menten ci da la velocità istantanea o iniziale relativa alla Vmax ad una data concentrazione di substrato ed è valida se v è misurata per brevissimi intervalli di tempo cosicché [S] rimane essenzialmente costante. Questo richiede che meno del 5% di [S] venga consumato durante la reazione STATO STAZIONARIO (BRIGGS E HALDANE) K1 Kp E + S ⇔ ES → E + P K-1 Se la velocità di formazione di E + P da ES e maggiore della velocità di dissociazione di ES in E+S cioè: kp>k-1 allora E, S e ES non saranno in equilibrio. A tal punto se consideriamo la concentrazione di S notevolmente maggiore di E, possiamo supporre che appena E ed S saranno in presenza l'uno dell'altro, immediatamente essi reagiranno formando ES, raggiungendo uno stato stazionario (steady-state) nel quale la concentrazione di ES rimane essenzialmente costante nel tempo Curva di progressione per una reazione catalizzata dove la concentrazione del reagente iniziale (substrato) [S]0 è significativamente più grande della concentrazione dell’enzima [E]t. Non appena il rapporto [S]0/[E]t incrementa, la regione regione relativa alla condizione di stato stazionario rappresenterà una sempre maggiore frazione del tempo totale di reazione. T rappresenta l’interavallo di stato pre-stazionario. Da quanto detto risulta immediato che allo stato stazionario le velocità di formazione e di dissociazione si equivarranno per cui avremo: k1[E][S]=(k-1+kp)[ES]; [ES] = k1[E][S] /(k-1+kp) il rapporto tra le tre costanti di velocità può essere definita come una singola costante, Km (Michaelis). Km=(k-1+kp)/k1 che sostituita alla relazione ottenuta nel caso dell'equilibrio rapido ci darà La Km, è una costante dinamica o di pseudo-equilibrio che esprime la relazione tra le concentrazioni reali allo stato stazionario, piuttosto che le concentrazioni all'equilibrio. Il valore di questa costante corrisponde alla concentrazione di substrato che produce una velocità semi-massimale. Infatti quando [S]=Km avremo: Significato dei parametri di Michaeli-Menten Significato della Kcat (Kp): La costante catalitica La costante catalitica è detta spesso numero di turnover dell’enzima perché rappresenta il numero massimo di molecole di substrato convertito in prodotto per sito attivo per unità di tempo, o il numero di volte che l’enzima <turnover> (<reinizia>) per unità di tempo. La Kcat è una costante di velocità di primo ordine che si riferisce alle proprietà e alle reazioni dei complessi enzima-substrato [ES], enzima-intermedio [EX] e enzimaprodotto [EP]. E’ possibile definire la costante catalitica, Kcat, di un enzima come: Significato della Km: La Km è la concentrazione di substrato alla quale v = Vmax/2. La Km è una costante di dissociazione apparente che può essere trattata come la costante di dissociazione complessiva di tutte le specie legate ali enzimi. Significato di Kcat/Km: La costante di specificità La velocità di reazione per basse concentrazioni di substrato è data da Cioè Kcat/Km è una costante di velocità apparente di secondo ordine. L’importanza di Kcat/Km è che questo termine mette in relazione la velocità di reazione con la concentrazione dell’enzima libero piuttosto che con quella totale; infatti a basse concentrazioni di substrato l’enzima è in gran parte non legato [E] < [E]o per cui In conclusione Kcat/Km è una costante di velocità apparente di secondo ordine che si riferisce alle proprietà e alle reazioni dell’enzima libero e del substrato libero. PERCHE' DETERMINARE LA Km La determinazione del valore numerico della Km è interessante per le seguenti ragioni. a) la Km ci da un' indicazione approssimativa della concentrazione intra cellulare del substrato; b) poiché Km è una costante per un dato enzima, conoscere il suo valore ci permette di comparare enzimi di differenti organismi o di diversi tessuti dello stesso organismo; c) la presenza di un ligando che induce cambiamenti nel valore della Km è un modo per regolare l'attività di un enzima. Se il valore della Km valutata in vitro è fisiologicamente troppo elevata avremo una indicazione sulla presenza di un attivatore che in vivo diminuirà il valore della Km d) conoscendo la Km possiamo ottimizzare le condizioni di dosaggio ([S]>Km)e quindi determinare la Vmax, che è una misura di [Et]; e) la costante di Michaelis indica la convenienza per un enzima ad usare un substrato piuttosto che un altro. Il substrato ottimale è quello che ha il maggiore rapporto Vmax/Km. Non applicabilità dell’equazione di Michaelis-Menten Oltre a ragioni banali quali l’incapacità sperimentale di misurare le velocità iniziali, ci sono due ragioni principali per la no applicabilità dell’equazione di MichaelisMenten. 1) Inibizione da substrato: una seconda molecola di S si lega per dare un complesso ES2, cataliticamente inattivo v=[E]0[S]Kcat/Ks + [S] +[S]2/K’s All’aumentare di [S] la v diminuisce 2) Attivazione del substrato: si forma un complesso ES2 che è più attivo di ES. REAZIONI REVERSIBILI -EFFETTO DELPRODOTTO SULLA VELOCITA'DI AVANZAMENTOIn generale, tutte le reazioni catalizzate da enzimi sono reversibili. K1 K2 K3 E + S ⇔ ES ⇔ EP ⇔ E + P K1 K-2 K-3 applichiamo l'equazione di Henri-Michaelis-Menten in ambedue le direzioni della reazione Quando [P]=0 e quando [S]=0 la direzione della reazione dipenderà dal rapporto [P]/[S] relativa alla Keq. Una equazione che esprima la velocità netta può essere derivata facilmente considerando la teoria dell'equilibrio rapido (dove Kms=Ks e Kmp=Kp). GRAFICAZIONE DEI DATI DI VELOCITA' CONTRO <<[S]>> L'equazione di Michaelis-Menten descrive la curva ottenuta dal plot dei dati di velocità iniziale in funzione di [S]. La curva descritta è un'iperbole rettangolare con un angolo di curvatura costante ed indipendente dai valori di Km e Vmax. Conseguentemente il rapporto tra le concentrazioni di substrato a due valori di Vmax è costante per tutti gli enzimi che obbediscono alla legge di Henri-Michaelis-Menten. Ad esempio il rapporto tra la concentrazione di S richiesta per una Vmax del 90% e quella per una Vmax del 10% è sempre 81 ORDINE DI REAZIONE Se esaminiamo la curva v vs [S] troviamo tre tipi di variazioni di v all'incremento di [S]. A concentrazioni molto basse di substrato [S]<0.01 Km, la curva è essenzialmente lineare cioè la velocità è direttamente proporzionale alla concentrazione di S (a). (cinetica di primo ordine) Essendo in queste condizioni [S]< Km il valore di [S] al denominatore della relazione di Michaelis può essere ignorata per cui avremo: v = Vmax [S]/Km ovvero v = kcat [S] A concentrazioni molto alte di substrato [S]>100Km , la velocità è essenzialmente indipendente dalla concentrazione di S (c) (cinetica di ordine zero). Essendo [S] molto maggiore di Km, il valore della costante può essere ignorata e l'equazione semplificata diventerà v = Vmax La velocità sarà costante ed indipendente dalla concentrazione di [S]. I plots di [S] e [P] contro il tempo saranno lineari. A concentrazioni intermedie di substrato , la relazione tra v ed [S] non segue ne una cinetica di primo ordine ne di ordine zero (b). METODI GRAFICI DI DETERMINAZIONE DEI PARAMETRI CINETICI Poiché la curva che si ottiene dal plot di v contro [S] è un'iperbole, risulta impossibile determinare il valore di Vmax e conseguentemente quello di Km essendo questo eguale alla concentrazione di [S] che da 1/2 Vmax. Per permettere la determinazione delle costanti cinetiche, i dati sono usualmente plottati in una delle forme lineari descritte di seguito. Plot di Lineweaver-Burk o dei doppi reciproci "1/v vs 1/[S]" Questo metodo utilizza il reciproco della equazione di Michaelis-Menten Come si può vedere in figura, le migliori misurazioni dei dati cinetici si ottengono raccogliendo i dati su un intervallo di [S] che va da circa 0,5 Km fino a circa 5 Km. Quindi, uno svantaggio dei grafici di Lineweaver-Burk è che la maggior parte delle misurazioni sperimentali di [S], sono concentrate nella parte sinistra del grafico. Inoltre, i dati riportati sulla parte destra e che influenzano maggiormente l’andamento delle retta di regressione, sono quelli meno precisi in quanto sono relativi a valori di [S] e conseguentemente di vo molto piccoli. Questo è un problema perché il piccolo errore presente in questi dati di velocità verrà enormemente amplificato nel momento in cui il dato verrà espresso in forma di reciproco. Plot di Hanes-Woolf "[S]/v vs [S]" L’equazione di Lineweaver-Burk può essere riarrangiata per ottenere l’equazione lineare per il plot Hanes-Woolf: moltiplicando ambo i membri dell’equazione per [S] essa diventerà: Plot di Eadie-Hofstee "v vs v/[S]" Plot di Eisenthal e Cornish-Bowden (diagramma diretto lineare) REGOLAZIONE DELL'ATTIVITA' ENZIMATICA -INIBIZIONE ENZIMATICAL'attività di un'enzima può essere regolata dalla presenza di composti che legandosi all'enzima lo attivano o lo inibiscono. E' importante notare che l'alterazione del comportamento cinetico non è in relazione al meccanismo molecolare per mezzo del quale l'attivatore o l'inibitore agiscono sull'enzima. Una reazione enzimatica inibita è definita come una reazione la cui velocità viene rallentata dalla presenza di sostanze chiamate inibitori. Tali sostanze possono esplicare la loro azione combinandosi sia col substrato, sia con eventuali attivatori, sia con forme diverse dell'enzima. La forma di combinazione più frequente, è quella enzima-inibitore, dove viene quindi a diminuire la quantità di enzima disponibile per la reazione. Il fenomeno dell'inibizione è di notevole importanza, poiché l'inibizione rappresenta uno dei principali sistemi di regolazione del metabolismo (inibizione a "feed-back”) ed è la base di azione di molti farmaci. TIPI DI INIBIZIONE - Inibizione da prodotto e dead-end L'inibizione da prodotto è stata già trattata a proposito delle reazioni reversibili. Una sostanza che non sia un prodotto di reazione e che si combina con l'enzima libero [EI] o legato ancora al prodotto (EQI nel caso di meccanismi non UNI UNI) non suscettibile di reagire ulteriormente , è un inibitore dead-end. Gli inibitori, come tutti gli altri fattori che influenzano la velocità di una reazione enzimatica, modificano Km e/o Vmax. Per una reazione UNI UNI che segua l'equazione di Michaelis linearizzata (Lineweaver-Burk) 1/v = 1/Vmax + (1/Ka) * 1/[A] vi sono tre tipi generali di inibizione reversibile, che vengono distinti in base alla famiglia di rette che si ottiene a varie concentrazioni di inibitore in un grafico dei doppi reciproci. Essi sono: 1. Inibizione competitiva 2. Inibizione incompetitiva 3. inibizione non competitiva Questi tre tipi di inibizione hanno in comune la formazione di un complesso dead-end [EI] o di un complesso non produttivo [EAI], od entrambi. Esistono, inoltre, altri due tipi di inibizione: L’inibizione mista e l’inibizione a feedback. INIBIZIONE COMPETITIVA Un inibitore competitivo è una sostanza che si combina con l'enzima libero in un modo che previene il legame del substrato. Ciò significa che il substrato e l'inibitore sono reciprocamente esclusivi, in quanto spesso competono per lo stesso sito. Un inibitore competitivo può essere un analogo, non metabolizzabile, del substrato, un derivato del vero substrato, o un substrato alternativo dell'enzima, o un prodotto della reazione. Un esempio classico di inibitore competitivo è l'acido malonico che inibisce la succinico deidrogenasi, la quale catalizza la ossidazione dell'acido succinico ad acido fumarico l'acido malonico somiglia all'acido succinico quanto basta per potersi legare al sito attivo dell'enzima. Nella figura sottostante il modello 1 illustra un classico esempio di inibizione competitiva nel quale un inibitore compete con un substrato per il sito attivo. I modelli 2-4 rappresentano altri modi con i quali un inibitore ed un substrato possono risultare mutuamente esclusivi: impedimento sterico (modello 2); impedimento sterico o competizione per un sito di legame comune (modello 3); copertura (overlapping) del sito di legame (modello 4); cambiamenti conformazionali indotti dall'inibitore e dal substrato rispettivamente al sito di legame ed al sito di inibizione (modello 5). In poche parole l’inibizione é definita competitiva quando l'inibitore compete col substrato nel legarsi al sito catalitico dell'enzima libero (competitiva pura), ovvero quando, per effetto del binding dell'inibitore, si osserva una variazione conformazionale della molecola enzimatica, con diminuita affinità per il substrato (parzialmente competitiva). Lo schema di reazione è il seguente: L’enzima totale sarà presente in tre forme: L’equazione di velocità che si deriva è la seguente: e nella forma reciproca essa diventa: Nella figura sottostante è riportata la risposta cinetica dell’enzima in assenza ed in presenza dell’inibitore: Il plot dei dati cinetici nella forma di doppi reciproci da una serie di rette con pendenza crescente al crescere della concentrazione dell’inibitore e con medesimo valore di intercetta. La distinzione di una inibizione competitiva pura da una parzialmente competitiva è possibile perché il replot del coefficiente angolare di ciascuna retta in funzione della concentrazione di I è lineare per l'inibizione competitiva pura, mentre l'altra da un replot iperbolico. Inibizione incompetitiva In questo tipo di inibizione l'inibitore si lega ad EA formando un complesso EAI e non si lega all'enzima libero. Lo schema di reazione è il seguente: L’enzima totale sarà presente in tre forme: L’equazione di velocità che si deriva è la seguente: che nella forma reciproca diventa: Nella figura sottostante è riportata la risposta cinetica dell’enzima in assenza ed in presenza dell’inibitore: Il plot dei dati cinetici nella forma di doppi reciproci da una serie di rette parallele al crescere della concentrazione dell’inibitore. In questo tipo di inibizione avremo una diminuzione della Vmax poiché una quota di E verrà sottratta alla reazione formando EAI. Anche il valore di Kmapp. sarà inferiore, poiché la formazione di EAI, rendendo indisponibile una certa quantità di EA, sposta l'equilibrio della reazione verso destra Il replot dei valori di intersezione delle rette del grafico precedente contro le concentrazioni di inibitore ([I]) risulterà lineare. Inibizione mista In questo tipo di inibizione, substrato ed inibitore si legano a siti diversi dell'enzima; il legarsi di uno dei due può influenzare oppure no la costante di dissociazione dell'altro. L'inibitore può legarsi ad E come ad EA, così come il substrato può legarsi sia ad E che ad EI, con la formazione di un complesso ternario non produttivo. Lo schema del meccanismo di reazione è il seguente: si può osservare che ad ogni concentrazione di I unaq parte dell’enzima è presente come complesso non-produttivo EAI. L’enzima totale Et, è presente in 4 forme: Quando il complesso EAI è non-produttivo l’equazione di velocità che si ricava è la seguente: che in forma di doppi reciproci diventa: α è il fattore che esprime come varia Ka quando il substrato si lega ad EI anziché ad E, o come varia Ki quando l'inibitore si lega ad EA anziché ad E. α misura quindi l'interferenza tra i due diversi binding, essendo: α = Ki'/Ki. Il plot dei dati cinetici nella forma di doppi reciproci da una serie di rette con pendenza e punto di intersezione sull’asse y crescente al crescere della concentrazione dell’inibitore (vedi figura seguente). Il replot dei valori di intersezione e delle pendenze delle rette del grafico precedente contro le concentrazioni di inibitore ([I]) risulterà lineare. Inibizione non competitiva Si ha quando α = 1, cioè quando A ed I non interferiscono nel loro rispettivo legarsi all'enzima. Le corrispondenti equazioni di velocità sono identiche a quelle della inibizione mista ma con α = 1. l’equazione di velocità è la seguente: Nel grafico primario le rette si incrociano sulle ascisse, poiché varia la Vmax apparente, ma non la Km. Nei relativi grafici secondari KiS e KiI coincidono, ciascuna essendo uguale a Ki. Inibizione a feedback Molte vie biosintetiche sono regolate mediante inibizione retro inibizione; cioè , il prodotto finale/i o uno o più prodotti che sono quasi alla fine della via metabolica controllano il flusso metabolico inibendo uno o più reazioni precedenti della via metabolica. Spesso, la massima retro inibizione è ottenuta dall'azione combinata di diversi prodotti finali. Questo impedisce che un prodotto finale di una via metabolica caratterizzata da diverse ramificazioni blocchi definitivamente la stessa impedendo all'organismo la produzione di altri prodotti finali collaterali. Nel percorso metabolico mostrato di seguito, il prodotto finale X può inibire l'enzima E5; il prodotto finale I può inibire l'enzima E9 ed ambedue I ed X insieme possono inibire E1 in modo cooperativo, concertato, cumulativo o additivo. Inibizione cooperativa (sinergica): Ognuno dei prodotti finali, I ed X, inibisce E1. L'inibizione cooperativa implica che I ed X non siano mutuamente esclusivi. Ambedue i prodotti finali possono combinarsi con E1 simultaneamente per formare un complesso EIX e/o EIXS dead-end. Inibizione concertata (multivalente): Ambedue i prodotti finali non hanno da soli particolare effetto su E1, ma in presenza l'uno dell'altro, l'attività dell'enzima è marcatamente inibita. L'inibizione concertata è un caso estremo di inibizione dove il legarsi di uno dei prodotti finali incrementa notevolmente l'affinità dell'enzima per l'altro prodotto finale. Inibizione cumulativa (parziale): Ognuno dei due prodotti finali è un inibitore parziale. Cioè , livelli saturanti di I in assenza di X e viceversa non sono in grado di portare la velocità di reazione a zero. Questo implica che EI ed EX possono legare S, ma non bene come E (inibizione parzialmente competitiva), o che EIS o EXS sono cataliticamente attivi, ma non attivi come ES (inibizione parzialmente noncompetitiva), o ambedue (inibizione parzialmente mista). La vera inibizione cumulativa si osserva quando sia I che X sono inibitori parzialmente non-competitivi. Inibizione additiva: Una vera inibizione additiva di I ed X può esplicarsi soltanto se esistono due distinti enzimi (o siti catalitici) ognuno sensibile soltanto ad uno dei due inibitori. Così, una concentrazione saturante di I o X da una inibizione parziale mentre la contemporanea presenza dei due darà una azione sinergica. Feedback inhibition. The conversion of L-threonine to L-isoleucine is catalyzed by a sequence of five enzymes (E1 to E5). Threonine dehydratase (E1) is specifically inhibited allosterically by L-isoleucine, the end product of the sequence, but not by any of the four intermediates (A to D). Regolazione Allosterica Regolazione per modifica covalente Multiple regulatory phosphorylations. The enzyme glycogen synthase has at least nine separate sites in five designated regions susceptible to phosphorylation by one of the cellular protein kinases. Thus, regulation of this enzyme is a matter not of binary (on/off) switching but of finely tuned modulation of activity over a wide range in response to a variety of signals. Regolazione attività per modifica strutturale
Scarica