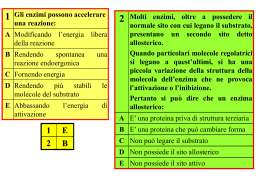
Cinetica enzimatica Gli enzimi sono catalizzatori nelle reazioni dei sistemi biologici Essi non sono gli unici catalizzatori biologici, esistono infatti: ribozimi e abzimi Quasi tutti gli enzimi sono proteine (ad eccezione di piccoli gruppi di molecole di RNA catalitico) con masse molecolari variabili (12000-1.000.000) L’attività catalitica dipende dall’integrità conformazionale della proteina nativa Molti enzimi necessitano di componenti chimici addizionali detti cofattori ioni inorganici (Fe2+, Mg2+, I cofattori possono essere Zn2+) coenzimi (molecole organiche o metallo-organiche) I cofattori legati covalentemente all’enzima vengono chiamati gruppi prostetici La parte proteica di un enzima è detta apoenzima l’insieme dell’apoenzima, dei coenzimi o degli ioni metallici costituisce l’oloenzima Esempi di enzimi che contengono come cofattori ioni inorganici Fe2+ o Fe3+ Cu2+ Zn2+ Mg2+ Catalasi Perossidasi Citocromo ossidasi Anidrasi carbonica Alcol deidrogenasi Glucosio-6-fosfatasi Piruvato chinasi Mn2+ Ribonucleotide reduttasi Ni2+ Ureasi Mo Dinitrogenasi Se Glutatione perossidasi Esempi di enzimi e coenzimi che trasferiscono gruppi chimici coenzima gruppi trasferiti enzimi nucleotidi fosfato P, B-Rib, B-Rib-P fosfotransferasi coenzima A gruppi acilici acil-transferasi tiamina pirofosfato gruppi idrossialchil. decarbossilasi piridossalfosfato gruppo amminico amminotransferasi biotina CO2 carbossilasi tetraidrofolato formil, metilen, metil transferasi C1 Gli enzimi sono catalizzatori speciali, favorendo le reazioni nelle condizioni biologiche (pH = 7.4; t = 37° C; ambiente acquoso intracellulare) Una caratteristica delle reazioni enzimatiche è proprio quella di avvenire all’interno di una particolare tasca, detta sito attivo; la molecola che si lega in maniera specifica al suo interno è detta substrato Specificità di substrato Le forze non covalenti attraverso le quali i substrati e le altre molecole si legano agli enzimi sono lo stesso tipo di forze che regolano le conformazioni delle proteine. In entrambi i casi sono coinvolte: 1. forze di Van der Waals 2. forze elettrostatiche 3. legami idrogeno 4. interazioni idrofobiche 9 In generale, un sito che lega il substrato è una cavità o una fessura sulla superficie di una molecola di enzima complementare, come forma, al substrato (complementarietà geometrica). I residui aminoacidici che formano il sito di legame interagiscono specificatamente con il substrato mediante forze attrattive (complementarietà elettrostatica). Nella maggior parte degli enzimi, i siti di legame per il substrato sono quasi sempre preformati, ma subiscono alcuni cambiamenti conformazionali in seguito al legame con il substrato (adattamento indotto) Gli enzimi modificano la velocità di reazione e non gli equilibri E + S ES E + P K 'eq = [ P] [S ] ∆G°' = − RT ln K 'eq La velocità di reazione dipende dalla concentrazione del reagente ( o dei reagenti) e dalla costante di velocità v = K [S ] Cinetica I° ordine v = K [ S ' ][ S ' ' ] Cinetica II° ordine L’equazione di Michaelis-Menten v 0 = v K max m S + [S ] Km = costante di Michaelis-Menten Vo = velocità iniziale Vmax= velocità allo stato stazionario Se v 0 = 1 ; 2 vmax [S ] ; 1 = 2 K m + S K m = [S ] = mol/l 1 1 K m + [S ] = [S ] 2 2 Equazione di Michaelis -Menten Tutti gli enzimi possono essere analizzati in modo da quantificare sia la velocità di reazione, sia la efficienza enzimatica PRIMA ASSUNZIONE La reazione complessiva è costituita da due reazioni elementari nelle quali il substrato forma un complesso con l’enzima che successivamente si decompone formando i prodotti e l’enzima libero: E + S K1 K-1 ES K2 P+E Seconda assunzione La tappa che limita la velocità la conversione del substrato in prodotto è la scissione del complesso ES in E + P. In queste condizioni la velocità iniziale diventa: Velocità iniziale = V0 = k2 [ES] Quando tutto l’enzima ha legato a sè il substrato, [Et] = [ES] e v0 =Vmax v0 = Vmax = k2 [Et] Terza assunzione La velocità complessiva di produzione di ES è data dalla differenza tra la velocità delle reazioni elementari che portano alla sua formazione e la velocità delle reazioni che ne determinano la scomparsa: Si assume che la concentrazione di ES si trovi in uno stato stazionario e resti costante durante la misura della velocità iniziale. La velocità di produzione del complesso ES da E e da S è semplicemente uguale alla velocità di demolizione del complesso ES in E + P ed E + S. Significato della costante di Michaelis La costante di Michaelis, Km, puo’ essere definita in modo semplice come: la concentrazione di substrato in cui [S] = Km, v0 = Vmax1/2, Km corrisponde alla concentrazione di substrato in cui la velocità della reazione è metà della velocità massima. Km è una misura dell’affinità dell’enzima Fattori che influenzano la Km Nella maggior parte dei casi il valore della Km è indipendente dalla quantità di enzima che viene usata per determinarla. Qualsiasi variazione dei parametri che influenzano il legame del substrato all’enzima produrrà un’alterazione del valore di Km Variazioni di questo tipo possono essere costituite da: 1. alterazioni dei permanenti della struttura dell’enzima o del substrato (cioè variazioni dei legami covalenti), 2. variazioni reversibili della distribuzione delle cariche 3. variazioni della conformazione dell’enzima che influenzano l’orientamento o l’accessibilità dei gruppi di legame. 4. Interferenze a livello della formazione del complesso enzimasubstrato da parte di sostanze presenti nella miscela di reazione. 5. Variazioni dello stato di ionizzazione dell’enzima e del substrato costituita principalmente dalle variazioni di pH. Dall’equazione di Michaelis-Menten, utilizzando i doppi reciproci, otteniamo l’eq. di Lineweaver-Burk (dipendenza lineare della velocità di reazione e la concentrazione del substrato) 1 1 K m = + v0 [S ] vmax v max I tipi di meccanismi catalitici utilizzati dagli enzimi sono stati classificati come: catalisi acido-basica catalisi covalente catalisi favorita da ioni metallici catalisi elettrostatica catalisi favorita da effetti di prossimità e di orientamento catalisi favorita dal legame preferenziale del complesso dello stato di transizione Catalisi acido-basica 1) processo in cui il trasferimento di un protone da un acido abbassa l’energia libera dello stato di transizione di una reazione (catalisi acida generale). 2) Una reazione può essere stimolata aumentandone la velocità dalla sottrazione temporanea di un protone da parte di una base (catalisi basica generale). Catalisi covalente con la catalisi covalente si aumenta la velocità della reazione mediante la formazione transitoria di un legame covalente La catalisi covalente si svolge in 3 tappe: 1) reazione nucleofilica tra il catalizzatore e il substrato con la formazione di un legame covalente 2) perdita di elettroni dal centro di reazione ad opera del catalizzatore elettrofilico 3) eliminazione del catalizzatore, una reazione che è essenzialmente l’inverso della prima tappa Esempi di gruppi nucleofilici e gruppi elettrofilici coinvolti nella catalisi covalente Catalisi favorita da ioni metallici . Quasi un terzo di tutti gli enzimi conosciuti richiede la presenza di ioni metallici per poter esprimere la sua attività catalitica 1. I metallo-enzimi, che contengono, come cofattori, ioni metallici saldamente legati, la maggior parte dei quali sono metalli di transizione come Fe2+, Fe3+, Cu2+, Zn2+, Mn2+ o Co2+.. 2. Gli enzimi attivati da metalli, viceversa, legano debolmente gli ioni metallici presenti in soluzione, di solito gli ioni di metalli alcalini o alcalini-terrosi come Na+, K+, Mg2+ o Ca2+. 14 Gli ioni metallici partecipano ai processi catalitici in 3 modi diversi: 1) si legano al substrato in modo da orientarlo correttamente per la reazione 2) partecipano a reazioni redox mediante il cambiamento reversibile del numero di ossidazione del metallo 3) stabilizzano elettrostaticamente o proteggono le cariche negative 14 Catalisi elettrostatica 1. Il legame del substrato di solito esclude l’acqua dal sito attivo di un enzima, che possiede quindi le caratteristiche di polarità di un solvente organico, in cui le interazioni elettrostatiche sono molto più forti che nelle soluzioni acquose. 2. I valori di pK delle catene laterali degli aminoacidi presenti nelle proteine possono variare di alcune unità rispetto ai loro valori normali. 3. Le distribuzioni di carica intorno al sito attivo degli enzimi sembrano essere determinate in modo da stabilizzare gli stati di transizione delle reazioni catalizzate Catalisi favorita da effetti di prossimità e di orientamento: Gli enzimi, nonostante utilizzino meccanismi catalitici che assomigliano a quelli delle reazioni organiche modello, sono cataliticamente molto più efficienti di questi modelli. Questa efficienza è data in relazione alla prossimità e orientamento dei substrati. Catalisi favorita dal legame preferenziale dello stato di transizione un enzima può legare lo stato di transizione della reazione che catalizza con un’affinità maggiore rispetto a quello dei suoi substrati o dei suoi prodotti. Gli enzimi possono essere inibiti in modo reversibile o irreversibile competitivi Gli inibitori possono essere: non competitivi incompetitivi Inibizione competitiva E + S ES E + I E+I L’inibitore competitivo si lega all’enzima nel sito catalitico impedendo il legame con il substrato. Generalmente l’inibitore competitivo spesso è una molecola che assomiglia al substrato. Questo tipo di inibizione diventa reversibile quando aumenta la concentrazione di substrato poiché aumenta la probabilità che l’enzima incontri il substrato. Vmax è invariata Km aumenta -1/Km -1/Km 6a reazione: sintesi di fumarato • il malonato inibisce l’enzima in modo competitivo, dovuto alla notevole somiglianza strutturale col succinato Gli inibitori non competitivi Un inibitore non competitivo si lega reversibilmente sia all’enzima libero sia al complesso enzima substrato: E + I EI ES + I ESI Il substrato si può legare anche al complesso EI: EI + S ESI I complessi EI ed ESI sono cataliticamente inattivi. Se una data concentrazione di inibitore inattiva una certa frazione delle molecole totali di enzima, un inibitore non competitivo abbassa il valore della Vmax. Le molecole di enzima che non legano l’inibitore hanno un’affinità normale per il substrato e quindi presentano una Km altrettanto normale. Inibizione non competitiva Vmax diminuisce Km invariata Inibizione incompetitiva Gli inibitori incompetitivi si legano ai complessi enzimasubstrato, ma non agli enzimi in forma libera: E + I Vmax diminuisce Km diminuisce ES + I Nessuna reazione ESI Il complesso ESI è cataliticamente inattivo e quindi il valore della Vmax diminuisce in presenza dell'inibitore e il valore di Km tende a diminuire, dato che la reazione E + S ES viene spinta verso destra man mano che l'inibitore rimuove il complesso ES FATTORI CHE INFLUENZANO L’ATTIVITA’ ENZIMATICA Attività di un enzima in funzione del pH Una tipica curva di attività di un enzima in funzione della temperatura. A temperature inferiori a quella ottimale la velocità della reazione catalizzata è ridotta in quanto il contenuto energetico delle molecole di substrato è troppo basso perché queste possano superare la barriera dell'energia di attivazione; A temperature superiori a quella ottimale la velocità è bassa perché diviene sensibile l'inattivazione termica delle molecole di enzima. Regolazione dell’attività enzimatica Modificazioni allosteriche (non covalenti) (enzimi allosterici) Modificazioni covalenti a) covalenti reversibili: b) covalenti irreversibili: Fosforilazione Proteolisi (zimogeni) Adenilazione Uridililazione ADP-Ribosilazione Metilazione Regolazione dell’attività enzimatica Enzimi allosterici (modificazione non covalente) Gli enzimi allosterici sono quelli che possiedono conformazioni indotte dal legame con modulatori (positivi o negativi). Se il modulatore è lo stesso substrato essi vengono denominati omotropici. Se il modulatore è una molecola diversa dal substrato, l’enzima viene detto eterotropico. Oltre ai siti catalitici, gli enzimi allosterici possiedono uno o più siti regolatori. Alcuni enzimi oligomerici possiedono delle subunità regolatrici che non possiedono di per sè attività catalitiche Fattori che influenzano le attività enzimatiche nel plasma negli stati patologici: • l’organo o il tessuto interessato dalla malattia • la natura della lesione • la distribuzione degli enzimi nel tessuto interessato • effetti secondari su altri organi • la velocità del rilascio dell’enzima da parte delle cellule danneggiate • la scomparsa dell’enzima dal circolo sanguigno Significato clinico dell’attività degli enzimi presenti nei materiali biologici Lo studio dell’attività enzimatica trova la sua applicazione nei laboratori di chimica clinica per l’accertamento di lesioni e/o alterazioni della funzionalità di organi e per la diagnostica di alcune malattie del metabolismo sostenute da enzimopatie per lo più congenite. Queste ricerche sono condotte su diversi materiali biologici: • siero • urina • succhi digestivi e feci • emolisati di emazie e preparati di leucociti • altri materiali Enzimi di interesse clinico che si presentano in forme multiple Lattico deidrogenasi Isocitrico deidrogenasi Glucosio-6-fosfato deidrogenasi Glutammico deidrogenasi Aspartico transaminasi Creatina chinasi Acetilcolinesterasi Colinesterasi Fosfatasi alcalina Isoenzimi Con il termine di isoenzimi o isozimi vengono indicate proteine che catalizzano la stessa reazione ma presentano diverse proprietà molecolari, cioè diversa carica elettrica, diversa solubilità, diversa resistenza ad agenti chimici e fisici. In alcuni casi gli isozimi differiscono tra di loro anche sotto il profilo funzionale e presentano differenze quanto ad optimum di pH, ad affinità, espressa in termini di costante di Michaelis per il substrato o i coenzimi. Nel siero, dove sono presenti enzimi provenienti da localizzazioni cellulari e tissutali diverse, alcune attività enzimatiche sono sostenute da più isoenzimi. Esochinasi: inibita dal glucosio 6-P Isoenzima tipo I: nel cervello (attivato dal Pi) Isoenzima tipo II: nel muscolo Deficienza ereditaria di esochinasi (anemia emolitica) Nel fegato sono presenti entrambi gli enzimi. Glucochinasi 1. Presente nel fegato 2. Specificità per il glucosio 3. Bassa affinità 4. Inducibile (dieta, insulina) Fosfofruttochinasi II o enzima bifunzionale PFK/FBPasi Fegato e cuore contengono differenti isoenzimi dell’enzima bifunzionale PFK/FBPasi che danno differente risposta allo stesso ormone (adrenalina). adrenalina glucagone Fegato: (inibizione della glicolisi) Cuore: (attivazione glicolisi)
Scaricare