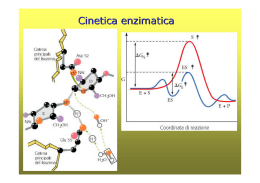
Gli Enzimi I Catalizzatori delle reazioni biologiche S.Miniato 2005 N2 CO2 H2 O NO2 CO CH S.Miniato 2005 Il metabolismo • Le cellule compiono migliaia di reazioni chimiche (esoergoniche ed endoergoniche). • L’insieme di queste reazioni costituisce il metabolismo cellulare. • L’accoppiamento energetico utilizza le reazioni esoergoniche per far avvenire le reazioni endoergoniche. Le reazioni chimiche consentono di immagazzinare o di liberare energia Le reazioni endoergoniche assorbono energia e danno origine a prodotti ricchi in energia potenziale (con un livello di energia chimica superiore a quella delle sostanze di partenza). Energia potenziale delle molecole Prodotti Energia assorbita Reagenti Quantità di energia assorbita Le reazioni esoergoniche liberano energia e danno origine a prodotti che contengono meno energia potenziale dei loro reagenti. Energia potenziale delle molecole Reagenti Quantità di energia liberata Energia liberata Prodotti Mappa metabolica Tutte le reazioni che avvengono nelle cellule sono reazioni catalizzate I catalizzatori di tali reazioni prendono il nome di enzimi Gli enzimi sono grosse molecole chiamate proteine Le proteine vengono formate dentro la cellula unendo tra di loro molecole più piccole, gli amminoacidi Mappa metabolica una via metabolica la glicolisi la glicolisi Caratteristiche degli enzimi • Sono in grado di agire a concentrazioni molto basse • Non subiscono trasformazioni • Favoriscono il procedere della reazione fino al raggiungimento dello stato di equilibrio Anche le reazioni di sintesi e di degradazione delle proteine richiedono la presenza di enzimi enzimi 6 7 8 5 4 9 11 3 12 2 13 1 proteina amminoacidi enzimi Gli enzimi abbassano l’energia di attivazione Gli enzimi accelerano le reazioni chimiche della cellula abbassando la richiesta energetica Perchè una reazione chimica inizi, i reagenti devono assorbire una quantità di energia chiamata energia di attivazione (EA). Enzima Barriera EA Reagenti Contenitore 1 Prodotti Contenitore 2 Gli enzimi abbassano l’energia di attivazione I substrati normalmente necessitano di una notevole quantità di energia (picco rosso) per giungere allo stato di transizione, e reagire per formare il prodotto. L'enzima crea un microambiente nel quale i substrati possono raggiungere lo stato di transizione (picco blu) più basso, riducendo così la quantità d'energia richiesta. Essendo più facile arrivare a uno stato energetico minore la reazione può avere luogo più frequentemente e la velocità di reazione sarà maggiore. Diagramma di una reazione catalitica che mostra l'energia richiesta a vari stadi lungo l'asse del tempo (coordinate di reazione). Analogie Enzima e Substrato Termini: • Substrato : il reagente che si lega al sito attivo di un enzima substrato Sito attivo • Sito attivo: la parte di enzima a cui si lega il substrato ed in cui avvengono le reazioni • il sito attivo è altamente specifico per un solo tipo di substrato Complesso enzima-substrato enzima substrato Complesso enzimasubstrato Enzima & prodotti la catalisi enzimatica A+B + CD enzima enzima Complesso enzimasubstrato Ingresso del substrato nel siti attivo enzima prodotti Complesso enzima-prodotti enzima Esempio di reazione catalizzata da un enzima 1 Enzima disponibile con il sito attivo vuoto Sito attivo Glucosio Substrato (saccarosio) Il substrato 2 si lega all’enzima che subisce un adattamento indotto Enzima (saccarasi) Fruttosio H2O 4 I prodotti vengono liberati 3 Il substrato si scinde nei prodotti Modello chiave-serratura L'enzima ed il substrato possiedono una forma esattamente complementare che ne permette un incastro perfetto. Tale modello è spesso definito come : chiave-serratura Modello dell’ adattamento indotto Enzima e substrato si modificano a vicenda. Si ritiene che la struttura del sito attivo non sia rigida ma flessibile, e presenti una conformazione capace di adattarsi alla forma del substrato Come risultato, il substrato non si lega semplicemente ad un sito attivo rigido, ma genera un rimodellamento del sito stesso, che lo porta ad un legame più stabile in modo da portare correttamente a termine la sua attività catalitica. Modello dell’ adattamento indotto L'enzima esochinasi è un buon esempio del modello ad adattamento indotto: quando il glucosio si avvicina al sito attivo l'enzima cambia conformazione, avvolgendosi attorno al substrato L’ambiente cellulare influenza l’attività degli enzimi La temperatura, la concentrazione dei sali e il pH influenzano l’attività enzimatica. • Per funzionare, alcuni enzimi richiedono molecole non proteiche chiamate cofattori. I cofattori possono essere: – sostanze inorganiche, come gli ioni metallo, – molecole organiche (in questo caso si chiamano coenzimi). Inibizione enzimatica Gli inibitori bloccano l’azione degli enzimi • Una sostanza chimica che interferisce con l’attività di un enzima è detta inibitore. • L’azione di un inibitore è irreversibile se si formano legami covalenti tra inibitore ed enzima. È reversibile quando si formano solo legami deboli (come il legame idrogeno). Inibizione enzimatica • Gli inibitori competitivi occupano il sito attivo di un substrato. • Gli inibitori non competitivi cambiano la funzione dell’enzima modificando la sua forma. Substrato Sito attivo Enzima Legame normale del substrato Inibitore competitivo Figura 5.8 Inibitore non competitivo Inibitore enzimatico Utilizzi degli inibitori • Gli inibitori sono spesso utilizzati come farmaci, ma possono agire anche come veri e propri veleni. • Un esempio di inibitore utilizzato come farmaco è l'aspirina, che inibisce l'attività delle ciclossigenasi COX-1 e COX-2, che producono le prostaglandine, mediatori dell'infiammazione, riducendo dunque la sensazione di dolore. • Il cianuro è invece un inibitore irreversibile che si combina con il rame ed il ferro presenti nel sito attivo dell'enzima citocromo c ossidasi, bloccando la catena di trasporto degli elettroni e, di conseguenza, la respirazione cellulare. In conclusione controllo metabolico = controllo cinetico controllo cinetico = controllo enzimatico gli enzimi = catalizzatori modulabili gli enzimi = sensori molecolari con attività catalitica
Scaricare