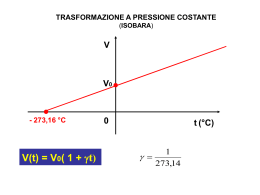
GAS PERFETTI E GAS REALI ALL’EQUILIBRIO IDEAL VS REAL GAS Antonio Ballarin Denti [email protected] LA LEGGE DI BOYLE (Robert Boyle 1627-1691) Le variabili di stato che descrivono le proprietà di un gas sono: volume (V), pressione (P) e temperatura (T) Il volume occupato da una data massa di gas, a temperatura costante, è inversamente proporzionale alla pressione P La trasformazione da A(pA, VA) a B(pB, VB) è isoterma e la curva PV = k è un’iperbole A B V I LEGGE DI GAY-LUSSAC (p = cost) Trasformazione isobara Relazione lineare II LEGGE DI GAY-LUSSAC (V = cost) Trasformazione isocora Relazione lineare P P0 T Anche le superfici si espandono con T Sia A0 = L0 × L0 a T0. Alla temperatura T si avrà: Trascuriamo poiché α << 1 Posto T0 = 0 Posto 2α = β β è il coefficiente di espansione planare Per i volumi si definisce un coefficiente di dilatazione volumetrica γ (per T0 = 0) (per 3α = γ) Per i gas (a pressione costante) vale la I legge di Gay Lussac: [K-1] I GAS PERFETTI – EQUAZIONE DI STATO PROPRIETÀ DEI GAS PREFETTI -IL NUMERO DELLE SUE MOLECOLE è GRANDE -IL GAS È RAREFATTO (NO INTERAZIONI TRA MOLECOLE) -LA SUA TEMPERATURA È >> DELLA T DI LIQUEFAZIONE Troviamo l’equazione di stato. Nella I legge di Gay-Lussac si ha: Passando alla temperatura assoluta (t = T-273) AB P P C B P0 * A BC V V0’ V0 ** Sostituendo * in ** Il prodotto pressione-volume è proporzionale alla T assoluta LA MOLE E IL NUMERO DI AVOGADRO Definizioni: I pesi atomici sono le masse degli atomi espresse In un’unità di misura definita come la dodicesima parte della massa del I12C Analogamente si definiscono i pesi molecolari Mole è la quantità di materia la cui massa espressa in grammi è uguale al peso atomico (o molecolare) Il numero di atomi in una mole è il numero di Avogadro NA = 6.02 × 1023 LA LEGGE DI AVOGADRO “una mole di gas a qualunque p e T costanti occupa sempre lo stesso volume (volume molare)” VM=22.414 litri P0 e 273 sono termini fissi, V0 sarà proporzionale al numero di moli del gas. Possiamo porre: R è la costante dei gas perfetti: L’equazione di stato dei gas perfetti diventa dunque: Dove m è la massa del gas ed M il suo peso molecolare COMPORTAMENTO DEI GAS REALI Scostamento della funzione pV = f(p) dal suo valore in base alla legge di Boyle PV Solo nei punti a derivata 0 T =500 K (punti di Boyle) abbiamo pV = cost. Il gas è meno compressibile 400 ad alte pressioni. A basse T la compressione determina 300 la liquefazione del gas 200 P (atm) COMPORTAMENTO DEI GAS REALI Un’isoterma reale si compone di 3 parti: n 1. Il tratto ad (basse pressioni) tipico della legge di Boyle 2. Il tratto orizzontale ba tipico del processo di liquefazione 3. Il tratto bn fortemente ascendente tipico dello stato liquido(incomprimibile) L+V C è il punto di rugiada (comincia la liquefazione) I GAS REALI Per un gas perfetto vale U=T Per un gas reale invece si ha: U= T + V energia interna del gas reale energia cinetica del moto di agitazione termica un’energia potenziale, tanto maggiore quanto più lontane sono le sue molecole Inoltre le molecole di un gas reale non sono puntiformi e hanno quindi volume non nullo Date queste differenze possiamo vedere come diventa l’equazione di stato per un gas reale Consideriamo che per un gas perfetto vale: V/M è il volume specifico VS Van der Waals modifica questa espressione e ottiene l’equazione di stato per i gas reali: Effetto delle interazioni molecolari Termine di covolume, tiene conto del fatto che le molecole hanno un volume proprio Mescolando vari gas si ha: Con ni = numero moli dei singoli gas, i= 1,..,n Per ogni singolo gas vale : pi = pressione parziale Sommando su tutti i costituenti: Vale quindi la Legge di Dalton
Scaricare