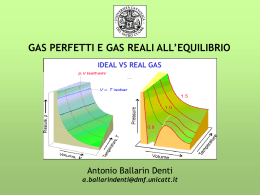
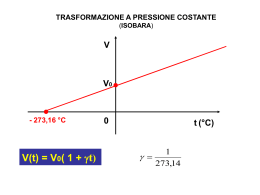
Laurea in Logopedia corso integrato FISICA - disciplina FISICA MEDICA TERMODINAMICA DEI GAS - GAS PERFETTI - GAS REALI GAS 1 1 GAS PERFETTI (volume proprio nullo) molecole puntiformi urti elastici (stesse particelle prima e dopo l'urto) prima parametri termodinamici : p, V, t dopo (sistema termodinamico semplice) prima prima urti non elastici (anelastici) dopo GAS 2 dopo 2 GAS PERFETTI LEGGI dei GAS PERFETTI legge di Boyle : t = costante pV= costante Ia legge di Gay-Lussac : p = costante Vt = Vo(1 + a t) IIa legge di Gay-Lussac : V = costante pt = po(1 + b t) 1 a=b= 273° legge di Avogadro : gas 1 e gas 2 V1=V2 , p1= p2 , t1= t2 GAS 3 N1= N2 3 GAS PERFETTI condizioni iniziali po Vo 0°C dopo un'isoterma p' V 0°C dopo un'isocora (condizioni finali) p V t°C poVo = p' V p = p' (1 + a t) pV = poVo (1+ a t) equazione di stato dei gas perfetti GAS 4 GAS PERFETTI legge di Avogadro : n = 1 mole u.m.a. po = 1 atm 12C grammomolecola (mole) No = 6.02 1023 molecole 12.000 u.m.a. Vo (1 mole) = 22.41 litri NTP = condizioni normali di temperatura e pressione (1 atmosfera, 0°C) GAS 5 4 5 GAS PERFETTI temperatura assoluta T = t (°C) + 273° V = Vo (1 + t ) 273° t = – 273°C V=0 t < – 273°C V < 0 non reale t = – 273°C limite in natura pV = poVo (1+ a t) GAS 6 !! T pV = poVo 273° + t 273° 6 GAS PERFETTI poVo T= nRT pV = 273° n = n° moli R = costante dei gas perfetti n = 1 mole poVo 1 atm 22.4 l 0.082 l atm = = R= = 273° °K mole 273° K mole 5 Pa 22.4 10–3 m3 10 8.325 J = = 273°K mole °K mole GAS 7 GAS REALI molecole occupano volume proprio 1 v urti elastici e non elastici gas reale condensazione (fase liquida) solidificazione (fase solida) isoterme di un gas reale (p,V) T > Tc gas non può in alcun modo passare alla fase liquida (causa agitazione termica) Tc = temperatura critica GAS 8 GAS REALI p 2 isoterme di un gas reale Tc = temperatura critica gas pc T > Tc liquido vapore vapore saturo o GAS Vc 9 Tc T < Tc V GAS REALI equazione di stato dei gas reali equazione di Van der Waals ai (V – bi ) ( p + 2 ) = R T V covolume – bi gas perfetto V 3 n = 1 mole gas i-esimo gas reale V volume disponibile singola molecola = V – bi GAS 10 GAS REALI ai termine di pressione aggiuntivo 2 V pressione urti elastici + urti non elastici pressione interna > pressione pareti (manometro) • forze intermolecolari attirano molecole periferiche verso l'interno GAS 12 4 GAS REALI 5 gas reale gas perfetto quando : a) temperatura t >> Tc b) lontano dalle condizioni di condensazione (bassa pressione e grandi volumi) gas fisiologici e di impiego medico azoto ossigeno anidride carbonica acqua protossido d'azoto GAS 12 N2 O2 CO2 H2O N2O Tc a 37 oC: – 147.1 °C perfetto – 118.8 °C perfetto + 31.3 °C ??? +374.1 °C reale + 39.5 °C reale
Scaricare