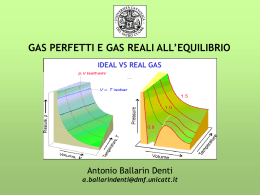
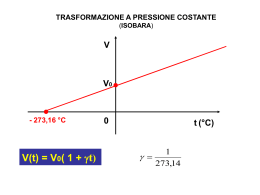
A differenza degli stati liquido e solido, quando un corpo si trova allo stato gassoso tende a occupare tutto il volume a disposizione GAS Leggi dei gas Leggi fisiche che descrivono il comportamento dei gas in funzione delle variabili di stato, quali volume, temperatura e pressione. Le particelle gassose hanno energia cinetica maggiore dell'energia di attrazione, perciò tendono ad occupare tutto lo spazio disponibile. Lo stato gassoso possiede diverse proprietà: •Bassa viscosità •Mancanza di forma e volume propri •Alta comprimibilità •Completa miscibilità tra loro •Esercizio di una pressione sulle pareti 1 proprietà estensive: massa, volume Le proprietà estensive dipendono dalla quantità di sostanza 2 proprietà intensive: temperatura, pressione Caratteristiche come composizione, struttura, stato di aggregazione, sono dette proprietà intensive e dipendono dalla natura delle sostanze ma non dalla loro quantità La Pressione è una Forza per unità di superficie, ed è data semplicemente dal rapporto P=F/S quando F è uniformemente distribuita su S. Nei gas la pressione è legata agli urti delle particelle contro le pareti del recipiente. La pressione si valuta generalmente misurando l'altezza di una colonna di mercurio (Hg) che il gas riesce a sostenere contro la forza di gravità. Al livello del mare e a 0° C, la pressione atmosferica media fa salire la colonna di Hg a 760 mm La pressione si misura in : •Pascal (SI) •Atmosfere •mmHg o Torr 1 torr= 133,322 Pa 1 atm=101325Pa Leggi dei gas valide per gas perfetti in cui le molecole hanno dimensioni puntiformi e non vi sono forze intermolecolari Relazione tra volume di un gas e pressione a T=costante Legge di Boyle P1V1=P2V2 ; PV = K A pressione costante, il volume di un gas è proporzionale alla temperatura e aumenta di 1/273(a) del volume che occupa a 0°C, per ogni aumento della temperatura di 1°C. V=Vo(1+at) Da questa evidenza esigenza di definire un valore di temperatura che corrisponda a -273° C. In base a tale valore, detto zero assoluto, è stata stabilita la scala della temperatura assoluta (Kelvin). A pressione costante il volume di un gas cresce con il crescere della temperatura Legge di Charles V1/V2= T1/T2 ; V/T= K Temperatura assoluta In °K Analogamente, a volume costante la pressione di un gas cresce al crescere della temperatura (legge di Gay Lussac): P1/P2= P/T = cost Effettuando in successione una trasformazione isocora ed una isoterma e applicando le relative leggi, si arriva alla relazione valida quando cambiano tutte e tre le variabili PV/T = cost =R Tale relazione è applicabile ai gas perfetti considerando: •Molecole puntiformi •Assenza di interazioni Per definire uno stato di un gas perfetto, sono necessarie e sufficienti tre variabili macroscopiche, ciascuna suscettibile di misura diretta: P, V, T legate tra loro dall’ equazione di stato dei gas perfetti PV = nRT P è il valore della pressione del gas; V è il volume occupato dal gas; n è il numero di moli del gas; R è la costante universale dei gas, il cui valore è funzione delle unità di misura adottate per esprimere le altre grandezze nell'equazione; T è la temperatura assoluta del gas, generalmente espressa in Kelvin. dove R = 0.082 l atm mol-1 K-1 nel SI K-1 R = 8.3143 J mol-1 Legge di Avogadro: " Volumi uguali di gas nelle stesse condizioni di temperatura e di volume, contengono un ugual numero di molecole “ Una mole di qualunque gas, alle medesime condizioni di temperatura e di pressione, occupa lo stesso volume. A c.n. questo volume è pari a 22,4 l/mole La condizioni normali (c.n.) corrispondono a 1 atm e 0°C (273°K) L'equazione di stato dei gas perfetti descrive bene il comportamento dei gas reali per pressioni non troppo elevate e per temperature non troppo vicine alla temperatura di liquefazione del gas. In questi casi, una migliore descrizione del comportamento del gas è dato dall'equazione di stato di Van der Waals La legge di Van der Waals è una equazione di stato che estende la legge dei gas perfetti (1) PV= nRT con l'introduzione di due valori a e b (costanti di Van der Waals) che dipendono dalla sostanza in esame. La legge generale dei gas si applica correttamente solo al gas ideale o perfetto, costituito di particelle tutte uguali, con la stessa massa e con volume nullo (puntiformi) e non interagenti: è un modello che è stato costruito per razionalizzare il comportamento dei gas. Un gas reale è invece caratterizzato da particelle con un volume definito; se si vuole perciò applicare la legge dei gas a gas reali è necessario introdurre delle correzioni. Di un gas reale, per esempio, si può esaminare il fattore di comprimibilità Z La formulazione della legge di Van der Waals è la seguente: (2) Dove p è la pressione del gas, n la quantità di sostanza (numero di moli),V il volume occupato, R la costante universale dei gas e T la temperatura assoluta. La presenza di forze attrattive tra le molecole ha l'effetto di ridurre la pressione che il gas esercita sulle pareti del contenitore e la pressione viene ridotta di una quantità che è proporzionale 1/V² al volume V il "volume libero" V - n b, dove b è il volume molare "escluso", cioè il volume propriamente occupato dalle molecole di una mole di gas Nel gas perfetto non esiste volume escluso, ovvero le molecole sono immaginate come puntiformi. Teoria cinetica dei gas Ecin= ½ m v2 v= velocità media delle molecole Per i gas perfetti: PV = 1/3 N m v2 N= numero di molecole v2 = velocità quadratica media Per una mole di gas: PV = 1/3 NA m v2 PV = 2/3 NA (½ m v2) PV = 2/3 NA Ecin PV = RT RT = 2/3 NA Ecin Ecin= 3/2 RT/NA Ecin= 3/2 kT (per una molecola) (k= costante di Boltzmann= R/NA= 1.38 10-23 J K-1) Ecin mol= 3/2 RT (per una mole) L’energia cinetica di un gas ideale dipende solo dalla T assoluta ed è indipendente da P, V e dalla natura del gas A T=0 °K il moto di traslazione molecolare cessa Distribuzione delle velocità molecolari (Maxwell) Maxwell valutò statisticamente la distribuzione delle velocità nelle particelle di gas con la funzione di distribuzione di velocità che esprime la frazione di molecole DN/N che possiedono una certa velocità. A T più alte la velocità media è + bassa e aumenta la frazione di molecole con velocità che si avvicinano alla massima v v media velocità più probabile Un barometro a mercurio Legge di Graham= velocità di fuoriuscita di un gas da un piccolo foro inversamente proporzionale al suo PM v1/v2= t2/t1 = √PM2/ √PM1 MISCELE di GAS Se il sistema è costituito da una miscela di due o più gas che occupano lo stesso volume V, identificando ogni singola specie gassosa con i simboli A, B, ..i... e considerando che tutti si comportino come gas ideali, ognuno di essi seguirà la legge generale. Pressione parziale del gas i : pressione che il gas i eserciterebbe se occupasse da solo tutto il volume disponibile, dato che, considerando gas ideali, le particelle sono indistinguibili tra loro. Dati due gas A e B Legge di Dalton P = PA+PB Per i gas in miscela P= ∑Pi = ∑ni RT/V= Pi/P= ni/ ∑ni =i Pi= iP la pressione parziale di un gas i è data dal prodotto della sua frazione molare i per la pressione totale. Volume parziale di un gas= volume che un gas in miscela con altri occuperebbe se si trovasse da solo alla stessa pressione totale V= ∑Vi = ∑niRT/P Vi=ni/∑ni V= iV Il rapporto in moli equivale al rapporto in volume in una miscela di gas Densità dei gas Dall’equazione di stato dei gas perfetti PV =mRT/PM Si può ricavare la densità di un gas di peso molecolare PM d (g/l) = m/V= PM.P/RT Che è direttamente proporzionale a P e PM e inversamente alla T Densità relativa di 2 gas a e b da/b= da/db= PMa/PMb Gas reali se sottoposti ad una adeguata pressione e portati ad una T abbastanza bassa, condensano, diventando prima liquidi, poi solidi. passaggio alla fase liquida di un gas reale Portando in un diagramma P/V (diagramma di Andrews), i dati relativi si ottengono curve diverse a seconda delle varie T. C è detto punto critico ed è identificato da una coppia di valori di P e di V: PC= pressione critica VC= volume critico Il modello cinetico molecolare di un gas Tc = temperatura critica del gas al di sopra della quale non è possibile liquefare il gas, qualunque sia la P che si impone: il gas resta perciò sempre nel suo stato gassoso Le isoterme a T > TC, hanno un andamento simile a quello dei gas ideali Per non far reagire Na metallico violentemente con l’umidità presente, si aggiunge KNO3 che produce altro azoto reagendo con Na KNO3 +NaK2O + Na2O+ N2 gli ossidi metallici basici ottenuti reagiscono a loro volta con biossido di silicio dando un prodotto vetroso K2O + Na2O+ SiO2 vetro
Scaricare