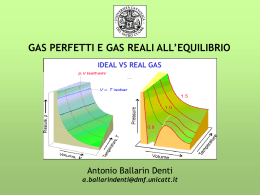
1 La lezione di oggi Il comportamento microscopico dei gas Il 1 principio della termodinamica 2 ! Equazione di stato dei gas ! Applicazioni dell’equazione di stato ! La teoria cinetica dei gas ! Il 1 principio della termodinamica 3 Equazione di stato dei gas ideali ! Gas ideale: non ci sono interazioni tra le molecole ! Condizioni standard ( T = 20 oC, P= 1 atm ) ! Gas reale in condizioni standard = gas ideale Se voglio aumentare la pressione P… Aumento la temperatura a V costante Aumento il numero di molecole (N) Equazione di stato dei gas perfetti Diminuisco il volume (V) P=k NT V 4 Equazione di stato dei gas ideali NT P=k V Equazione di stato dei gas perfetti P V = N k T k = 1.38 ⋅ 10 -23 J/K Costante di Boltzmann N: numero di molecole di gas ( ∝ massa) T in K, P in Pa, V in m3 PV =nRT n: numero di moli di gas ( T in K, P in Pa, V in m3 ∝ massa) R = kN Avogadro = (1.38⋅10-23 J/K)(6.022 ⋅1023 molecole/mole) = 8.31 J/(mole ⋅ K) 5 Moli e massa molecolare o o o o o Unità di massa atomica (u, o uma) è ottenuta assegnando arbitrariamente 12 u al 12C 1 u = 1 uma = 1.665.10-27 kg Una mole (o grammo-molecola) ! numero di Avogadro di quantità elementari (atomi, molecole,....) Una mole contiene tante quantità elementari quante ce ne sono in 12 grammi di 12C Una mole è il numero di grammi di sostanza uguale alla massa molecolare espressa in uma Problema Calcolare la massa di una molecola di ossigeno O2 m= M molecolare ossigeno N Avogadro -3 32.0 ⋅ 10 kg/mole - 26 = = 5.32 ⋅ 10 kg/molecola 23 6.02 ⋅ 10 molecole/mole massa di 1 mole = 32.10-3 kg 6 ! Equazione di stato dei gas ! Applicazioni dell’equazione di stato ! La teoria cinetica dei gas ! Il 1 principio della termodinamica 7 Trasformazioni isoterme Parto dall’equazione di stato dei gas PV =nRT Ipotesi: " T costante (trasformazione isoterma) " Massa costante Legge di Boyle Piniziale Viniziale = Pfinale Vfinale Nel piano PV le isoterme sono iperboli PV = k 8 Trasformazione isobara Parto dall’equazione di stato dei gas PV =nRT Ipotesi: " P costante (trasformazione isobara) " Massa costante Legge di Charles Viniziale Vfinale = Tiniziale Tfinale Nel piano VT le isobare sono rette V=k.T # T = 0, V = 0 # T = 0 ! zero assoluto 9 ! Equazione di stato dei gas ! Applicazioni dell’equazione di stato ! La teoria cinetica dei gas ! Il 1 principio della termodinamica 10 La teoria cinetica dei gas Pressione e temperatura ! grandezze macroscopiche ! Posizione o velocità di una molecola ! grandezze microscopiche ! Come faccio a misurarle ? o Macroscopiche: manometro e termometro o Microscopiche: ??? o Teoria cinetica dei gas: # # # # # gas ! insieme di molecole grande numero di molecole identiche ogni molecola ha massa m ed è puntiforme si muovono in modo casuale e obbediscono alle leggi di Newton solo urti elastici 11 Teoria cinetica e pressione dei gas Una molecola di massa m, con velocità v, in un contenitore di volume V urta contro la parete Quantità di moto p i,x = - mv x Prima dell’urto p f, x = mv x Dopo l’urto Δp x = 2mvx Variazione F parete su molecola causa la Δp Tempo necessario a fare andata e ritorno 2mv x mv F= = 2L/v x L 2 x 2L Δt= vx Pressione media 2a legge di Newton Δp ∑ F = Δt Δp ∑ F = Δt F mv 2x /L mv 2x P= = = 2 A V12 L Teoria cinetica e pressione dei gas Distribuzione delle velocità delle molecole di un gas a due temperature (Distribuzione di Maxwell) Velocità più probabile Generica velocità in 3 dimensioni (v2 ) m = (v2x ) m + (v2y ) m + (v2z ) m 2 2 2 Non ci sono direzioni privilegiate (v x ) m = (v y ) m = (vz ) m 2 2 x m 2 y m 2 z m 2 x m (v ) m = (v ) + (v ) + (v ) = 3 (v ) Nella pagina precedente avevamo ottenuto mv P= V 2 x Per N molecole ovvero 1 (v 2x ) m = (v 2 ) m 3 P / Km 1 m(v2 ) m 2 N Km P= N = 13 3V 3 V Energia cinetica e temperatura Equazione dei gas perfetti + PV =NkT 1 PV = Nm(v 2 ) m = NkT 3 Pressione nella teoria cinetica dei gas 1 m(v 2 ) m P= N 3 V 2 1 N( mv 2 ) m = NkT 3 2 L’energia cinetica media delle molecole di un gas è proporzionale alla Temperatura 1 K m = ( mv 2 ) m 2 3 K m = kT 2 Velocità quadratica media v qm = (v ) m = 3kT = m 2 3kT = (M/N A ) 3N A kT = M 3RT M 14 Esercizio Qual è l’energia cinetica media di una molecola di gas a 37 C ? 3 3 K m = kT = (1.38 ⋅ 10 -23 J/K)(273 + 37 K) = 6.4 ⋅ 10 −21 J 2 2 Calcolo l’energia cinetica media di una mole dello stesso gas alla stessa temperatura. K 1 mole di gas m 3 = N A ( kT) = 2 (6.02 ⋅10 23 molecole/mole)(6.4 ⋅10 -21 J/molecola) = 3900 J/mole 3700 J sono tanti o pochi ? Prendiamo una pietra di 1 kg e vediamo a che velocità devo lanciarla per avere questa K ? 2 ⋅ 3900 2K = 88 m/s = 320 km/h v= = 1 m 15 Esercizio Qual è la velocità quadratica media delle molecole presenti nell’aria (O2 e N2) a temperatura ambiente (20 C) ? m(O 2 ) = M O 2 ⋅ (u.m.a.) = (32)(1.66 ⋅ 10 -27 kg) =5.3 ⋅ 10 -26 kg v qm 3(1.38 ⋅ 10 -23 J/K)(273 + 20) 3kT = 480 m/s = 1700 km/h = = - 26 5.3 ⋅ 10 kg m m(N 2 ) = M N 2 ⋅ (u.m.a.) = (28)(1.66 ⋅ 10 -27 kg) =4.6 ⋅ 10 -26 kg v qm 3(1.38 ⋅ 10 -23 J/K)(273 + 20) 3kT = 510 m/s = 1800 km/h = = - 26 4.6 ⋅ 10 kg m 16 Energia interna di un gas ideale ! Energia interna: somma dell’energia potenziale e cinetica delle molecole che la compongono ! U = Σi (Ui + Ki) ! Gas perfetto: urti elastici ! ! Ui = 0 Ki = 3/2 kT 3 N 3 3 N A kT = nRT U = NkT = 2 NA 2 2 Numero di molecole Numero di moli 17 La legge di Dalton (o delle pressioni parziali) ! ! ! ! ! Considero una miscela di due gas perfetti I due gas non interagiscono/reagiscono tra di loro Le molecole non interagiscono tra di loro La pressione è data dagli urti delle molecole sulle pareti Il contributo alla pressione totale è indipendente per i 2 gas Gas 1 Gas 2 Gas (1+2) N1 k T P1 = V N kT P2 = 2 V Ptotale = Ptotale = P1 + P2 (N1 + N 2 ) k T V Legge di Dalton In una miscela, ciascun gas esercita la pressione che eserciterebbe se occupasse da solo tutto il volume 18 Esercizio Un pneumatico viene gonfiato a una pressione relativa di 200 kPa a T=10 C. Dopo un tragitto di 100 km, la T sale a 40 oC. Qual è ora la pressione del pneumatico ? " n costante (non aggiungo/tolgo aria) Condizioni a contorno " V costante (se varia il volume, varia di una quantità trascurabile) PV =nRT Equazione di stato dei gas perfetti Piniziale Pfinale = Tiniziale Tfinale 19 Esercizio PV =nRT Equazione di stato dei gas perfetti Piniziale Pfinale = Tiniziale Tfinale P e T assolute !!! Tfinale (273 + 40) K 5 3.01 ⋅ 10 Pa = 3.3 ⋅ 10 5 Pa = 330 kPa Pfinale = Piniziale = (273 + 10) K Tiniziale ΔP Pfinale - Piniziale 3.30 ⋅10 5 - 3.01⋅10 5 29 kPa = = = ≅ 0.10 = 10% 5 P Piniziale 3.01⋅10 301kPa La pressione è aumentata del 10% (!non trascurabile !) 20 ! Equazione di stato dei gas ! Applicazioni dell’equazione di stato ! La teoria cinetica dei gas ! Il 1 principio della termodinamica 21 Il primo principio della termodinamica ! ! ! ! Voglio applicare la legge di conservazione dell’energia Il calore è una forma di energia che viene scambiata Energia interna: somma di energie potenziale e cinetica di un sistema Caso 1: nel sistema entra una quantità di calore Q senza che venga compiuto del lavoro Uf = Ui + Q t = t0 t = t1 t = t2 Convenzione importante Il sistema acquista calore: Il sistema cede calore: ΔU = Uf - Ui = Q Q>0 Q<0 Uf > Ui Uf < Ui 22 Il primo principio della termodinamica ! Caso 2: il sistema compie un lavoro sull’ambiente esterno N.B. il sistema è termicamente isolato $ Q=0 Uf = Ui - L t = t0 t = t1 t = t2 ΔU = Uf - Ui = -L Convenzione importante Il sistema compie lavoro: Compio lavoro sul sistema: L>0 L<0 In generale, se Q e L sono entrambi diversi da 0, vale il Primo principio della termodinamica ΔU = Q - L 23 Il primo principio della termodinamica U, Q, L Q ! energia che fluisce per contatto termico L ! energia trasferita per azione di una forza che agisce su una distanza U dipende dallo stato del sistema (T, P, V) U ! FUNZIONE DI STATO Q e L dipendono da come il sistema cambia da uno stato all’altro 24 Trasformazioni reversibili e irreversibili ! ! ! ! ! Processi quasi-statici: sono molto lenti Il sistema è sempre in equilibrio con l’ambiente circostante Il valore di P e T è sempre uniforme in tutto il sistema Sistemi privi di attrito e forze dissipative Questi processi sono reversibili ! torno allo stato iniziale Nella realtà tutti i processi sono irreversibili (attrito,.....), ma noi faremo sempre l’approssimazione di processi reversibili 25 Trasformazione isobara P = cost Il gas si espande Il gas compie un lavoro L sul pistone L = F ⋅ (x f - x i ) = P ⋅ A ⋅ (x f - x i ) = P ⋅ (Axf - Ax i ) = L = area sotto la curva che rappresenta la trasformazione nel diagramma PV P ⋅ (Vf - Vi ) = P ⋅ ΔV Primo principio della termodinamica Q = ΔU + P. ΔV 26 Trasformazione isocora Il recipiente contiene un gas L = F ⋅ (x f - x i ) = 0 Area = 0 Fornisco una quantità di calore Q Il volume rimane costante Trasformazione isocora ! L = 0 Primo principio della termodinamica ΔU = Q 27 Trasformazione isoterma Espansione isoterma Equazione dei gas perfetti PV =NkT T = costante P V = costante costante P= V & Vf L = NkT ln$$ % Vi Il lavoro L è l’area sottesa dalla curva Nel piano PV la trasformazione è descritta da un’iperbole # & Vf !! = nRT ln$$ " % Vi # !! " Nota. Se comprimo il gas, Vf/Vi<1, ln(Vf/Vi )<0, L<0, compio lavoro sul 28 sistema Trasformazione adiabatica Non ho scambio di calore con l’esterno Q=0 Compressione adiabatica Una compressione veloce è una buona approssimazione di adiabatica Espansione adiabatica P V = costante γ 29 Il primo principio della termodinamica Trasformazione Grandezza costante In base al primo principio: Isobara P = costante Q = ΔU + L= ΔU + PΔV V = costante ΔV = 0 quindi L = 0 Q = ΔU Isoterma T = costante ΔT = 0 quindi ΔU = 0 Q=L Adiabatica Q=0 ΔU = -L Isocora 30 Esercizio n. 72, pag. T124 Walker Un cilindro dotato di un pistone mobile contiene 2.50 moli di argon a temperatura costante di 295 K. Quando il gas viene compresso isotermicamente, la sua pressione aumenta da 101 kPa a 121 kPa. Trovare: 1. Il volume finale del gas 2. Il lavoro compiuto dal gas 3. La quantità di calore fornita al gas 31 1. Il volume finale del gas Equazione dei gas perfetti PV =nRT R = 8.31 J/(mol ⋅ K) n R T 2.5 ⋅ (8.31) ⋅ (295) -2 3 Vf = = = 5.1 ⋅ 10 m Pf 121 ⋅ 10 3 2. Il lavoro compiuto dal gas & Vf L = nRT ln$$ % Vi & Pi L = nRT ln$$ % Pf # & Pi !! = nRT ln$$ " % Pf # !! " # & 101 ⋅ 10 3 !! = (2.5) ⋅ (8.31) ⋅ ln$$ 3 121 ⋅ 10 % " # !! = - 1.1 kJ 32 " 3. La quantità di calore fornita al gas 1 principio della termodinamica ΔU = Q - L# Q = ΔU + L = 0 + (-1.1 kJ) = - 1.1 kJ 33 Riassumendo La conservazione dell’energia porta alla formulazione del 1 principio della termodinamica 34
Scaricare