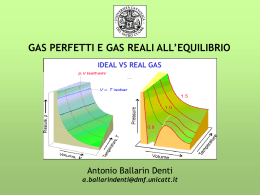
Stato gassoso Stati di aggregazione della materia SOLIDO: Forma e volume propri. LIQUIDO: Forma del recipiente in cui è contenuto, ma volume proprio. GASSOSO: Forma e volume del recipiente in cui è contenuto. Parametri di stato Volume: in m3, oppure (non ufficialmente) in L Massa: in kg, oppure in mol Pressione: in N m-2 = Pa, oppure in atm Temperatura:in K, oppure (non ufficialmente) in °C Costituenti dell’aria Costituenti dell'aria Nome Formula Percentuale in volume 78,110 Azoto N2 20,953 Ossigeno O2 0,0934 Argon Ar 0,0034 Biossido di carbonio CO2 -3 1,82 10 Neon Ne 5,2 10-4 Elio He 1,5 10-4 Metano CH4 1,1 10-4 Krypton Kr -5 5 10 Idrogeno H2 3 10-5 Ossido d’azoto N2O 8,7 10-6 Xenon Xe Reazioni in fase gassosa Calore 2 HgO(s) 2 Hg( l ) O 2( g ) Calore CaCO3(s) CaO(s ) CO 2( g ) Calore NH 4Cl(s) HCl (g) NH 3(g) 4 C3H 5 NO 3 3 Calore (l) 6 N 2(g) 12 CO 2(g) O 2(g) 10 H 2O(g) Ss O 2g SO 2g 2 SO 2g O 2g 2 SO 3g N 2g O 2g 2 NOg 2 NOg O 2g 2 NO 2g MISURA DELLA PRESSIONE DEI GAS Torricelli vuoto 76,0 cm Evangelista Torricelli (1608-1647) mercurio ESPERIMENTO DI BOYLE Patm P = Patm + P 1/V Robert Boyle, 1629-1691 P P V P 1/V con T,n = cost. Legge di Avogadro (1811): “Due gas di egual volume, alla stessa temperatura e pressione, contengono lo stesso numero di molecole” A. Avogadro (1776 – 1856) Pn con T,V = cost. Charles e Gay -Lussac P -273,15 °C Jacques Charles (1746-1823) 0 °C t (°C) V Joseph Louis Gay-Lussac (1778-1850) 0K T (K) gradi Kelvin = gradi Celsius + 273,15 Scale termometriche Fahrenheit Daniel Gabriel Fahrenheit (1686-1736). Inventore del termometro ad alcool e del termometro a mercurio. Lo zero è fissato alla temperatura di una miscela di acqua e ghiaccio. La temperatura di ebollizione dell’acqua è posta uguale a 212 ° mentre quella di fusione del ghiaccio è posta uguale a 32°. Celsius Anders Celsius (1701-1744) Lo zero è fissato alla temperatura di fusione del ghiaccio mentre la temperatura di ebollizione dell’acqua è posta a 100 °. LEGGE DI STATO DEI GAS P 1/V con T,n = cost. Pn con T,V = cost. (Avogadro) PT con V,n = cost. nT P V (Boyle) (Gay Lussac, Charles) oppure PV = n R T R = costante universale dei gas = 0,0821 L atm mol-1 K-1 = 8,314 J mol-1 K-1 PV nRT peso in grammi g g n ; PV RT peso molecolare M M RT peso molecolare M g PV g P densità gassosa d M V RT MISCELE DI GAS PTOT = PA+ PB+ PC nTOT = nA+ nB+ nC PA PB RT PA n A V nC nA nB XA ; XB ; XC n T OT n T OT n T OT PC X PA ; X PB ; X PC A B C PT OT PT OT PT OT COMPRIMIBILITÀ DI UN GAS PV Z nRT Quando Z=1, si dice che il gas ha un comportamento ideale (gas ideale) Quando Z1, si dice che il gas non ha un comportamento ideale (gas reale) Attrazione a grande distanza. Repulsione a corta distanza. Johannes Diderik van der Waals Leyden 1837 – Amsterdam 1923 (Premio Nobel per la Fisica, 1910) volume occupato da un gas reale > volume occupato da un gas ideale Videale Vreale n b pressione di un gas reale < pressione di un gas ideale 2 n Pideale Preale a 2 V Equazione di stato di van der Waals dei gas reali PidealeVideale nRT 2 n P a V n b nRT 2 V Gas a (l2 atm mol-2) b (l mol-1) H2 0,2444 0,02661 He 0,03412 0,02370 N2 1,390 0,03913 O2 1,360 0,03183 CO 1,485 0,03985 NO 1,340 0,02789 CO2 3,592 0,04267 H2O 5,464 0,03049 PV V a n z nRT Vnb RTV 1 an z nb RTV 1 V z > 1 Prevalgono forze repulsive (b) z < 1 Prevalgono forze attrattive (a)
Scaricare