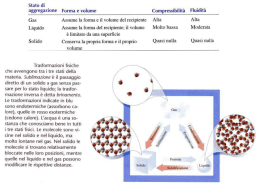
5. I Gas • La Natura Molecolare dei Gas • La Pressione • Le Leggi dei Gas - la legge di Boyle - la legge di Charles e Gay-Lussac - il principio di Avogadro - la legge dei gas ideali • Le Miscele Gassose • Il Modello Cinetico dei Gas - la distribuzione di Maxwell delle velocità • I Gas Reali • Effetto Joule-Thomson La Natura Molecolare dei Gas Il gas è uno stato fluido della materia che riempie il recipiente occupato e si lascia facilmente comprimere. MODELLO CINETICO ACQUISTA LA FORMA DEL CONTENITORE COMPRIMIBILE MOVIMENTO MOLTO VELOCE 0 °C 100 °C 1000 °C V=6100 km/h V=7130 km/h V=13320 km/h La Pressione Def. La PRESSIONE, P, è la forza esercitata dal gas divisa per l’area di superficie sulla quale la forza stessa si esercita. Forza Pressione Area Il BAROMETRO misura la pressione esercitata dall’atmosfera. 1 Pa = 1 kg∙m-1∙s-2 = 1 N m-2 SI 1 bar = 105 Pa = 100 kPa 1 atm = 1.01325x105 Pa = 101.325 kPa 1 atm = 760 torr = 760 mm Hg 1 torr = 1 mm Hg 1 atm = 14.7 psi La Pressione La Legge di Boyle Comprimendo una determinata quantità di gas a temperatura costante, la pressione del gas aumenta. Pressione, P Pressione, P ISOTERMA Volume, V 1/Volume, 1/V La PRESSIONE è INVERSAMENTE PROPORZIONALE al VOLUME 1 costante P ossia P V V LEGGE DI PV costante BOYLE La Legge di Boyle La PRESSIONE è INVERSAMENTE PROPORZIONALE al VOLUME 1 costante P ossia P V V PV costante La Legge di Charles e Gay-Lussac Volume, V Volume, V Per una determinata quantità di gas mantenuto a pressione costante, il volume varia in modo lineare con la temperatura. ISOBARA Temperatura, T -273 °C 0 °C Temperatura, T Il VOLUME è DIRETTAMENTE PROPORZIONALE alla TEMPERATURA V T ossia V costante T LEGGE DI CHARLES e GAY-LUSSAC La Legge di Cherles e Gay-Lussac Pressione, P Per una determinata quantità di gas mantenuto a volume costante, la pressione varia in modo lineare con la temperatura. Temperatura, T La PRESSIONE è DIRETTAMENTE PROPORZIONALE alla TEMPERATURA P T ossia P costante T LEGGE DI CHARLES e GAY-LUSSAC Il Principio di Avogadro Nelle medesime condizioni di pressione e temperatura un dato numero di molecole occupa lo stesso volume, indipendentemente dalla sua identità chimica. 1 mol, T = 0 °C, P = 1 atm 22.41 Gas ideale Argo 22.09 22.26 Anidride carbonica Azoto 22.40 Ossigeno 22.40 Idrogeno 22.43 Il VOLUME è DIRETTAMENTE PROPORZIONALE al NUMERO delle MOLI V n ossia V costante n Volume Molare Vm volume occupato V quantità di materia n PRINCIPIO di AVOGADRO La Legge dei Gas Ideali Legge di Boyle PV = costante Legge di Charles e Gay-Lussac Principio di Avogadro V = costante x T V = costante x n P = costante x T Legge dei Gas Ideali V PV = nRT Legge di Boyle n,T = costante RT n P Principio di Avogadro T,P = costante Legge di Charles n,P = costante PV = costante nR V T P V = costante x T V = costante x n Legge di Charles n,V = costante P nR T V P = costante x T La Legge dei Gas Ideali 8.20578 x 10-2 L∙atm∙K-1∙mol-1 PV = nRT 8.31451 x 10-2 L∙bar∙K-1∙mol-1 8.31451 J∙K-1∙mol-1 PV R costante dei gas nT Vm d volume occupato V quantità di sostanza n massa volume 62.364 L∙torr∙K-1∙mol-1 T = 0 °C, P = 1 atm (STP) Vm = 22.41 L∙mol-1 n x massa molare d n x volume molare Legge di Boyle V 1 P La densità di un gas AUMENTA all’AUMENTARE della PRESSIONE massa molare volume molare Legge di Charles V T La densità di un gas DIMINUISCE all’AUMENTARE della TEMPERATURA La Stechiometria delle Reazioni Massa Molare A Volume Molare B Stechiometria Massa A Moli di A Moli di B Volume B Le Miscele Gassose PV = nRT John Dalton LEGGE DELLE PRESSIONI PARZIALI: la pressione totale di una miscela di gas è la somma delle pressioni parziali dei suoi componenti. P PA PB Pi PRESSIONE PARZIALE: pressione che ciascun gas eserciterebbe se si trovasse da solo nel recipiente. La Legge di Dalton Il Modello Cinetico dei Gas 1. Un gas è un insieme di particelle in continuo movimento casuale. 2. Le particelle dei gas sono infinitamente piccole. 3. Queste particelle puntiformi si muovono in linea retta fino a quando non subiscono un urto. 4. Le particelle non si influenzano a vicenda se non durante l’urto. Def. Si chiama CAMMINO LIBERO MEDIO la distanza che una particelle 1930 mediamente percorre tra un urto e un altro. T = 25 °C [m∙s-1] Idrogeno Acqua 515 Azoto 410 480 Ossigeno 640 Anidride carbonica temperatur a v massa molare La Distribuzione di Maxwell delle Velocità temperatur a v massa molare modulo v verso direzione Def. Definiamo DISTRIBUZIONE DELLE VELOCITÀ MOLECOLARI la frazione delle molecole di gas che si muovono con una data velocità a un dato istante. Numero di molecole Numero di molecole James Maxwell Velocità Velocità I Gas Reali PV = nRT Le particelle dei gas sono infinitamente piccole. Le particelle non si influenzano a vicenda se non durante l’urto. I Gas Reali Johannes van der Waals pressione volume molare RT (P + DP) (Vm - DV) P ΔP Vm ΔV RT Equazione di van der Waals a P 2 Vm b RT Vm a Vm2 b Le interazioni molecolari aumentano all’aumentare della densità. covolume Specie gassosa a (atm∙L2∙mol-2) b (L∙mol-1) He 0.034 0.024 H2 0.25 0.027 NO 1.34 0.028 Ar 1.35 0.032 N2 1.39 0.039 O2 1.36 0.032 CO 1.49 0.040 Effetto Joule-Thomson I GAS REALI IN ESPANSIONE SI RAFFREDDANO LIQUAFAZIONE DEL GAS
Scaricare