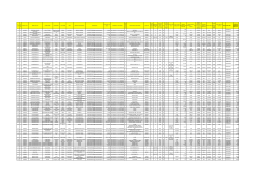
Per una determinata massa gassosa indipendentemente dalla sua natura rimane costante il valore del rapporto tra il prodotto della pressione per il volume e la temperatura assoluta PV / T = K i tre parametri variano in modo che i nuovi valori mantengono costante il valore del rapporto iniziale P1.V1/T1 = P2.V2/T2 = P3.V3/T3 = K P 10 20 5 20 30 V 10 20 30 5 5 T K 100 1 400 1 150 1 100 1 150 1 Pressione*volume/temperatura=costante La legge generale può essere scritta anche come PV=KT e indicando la massa gassosa con il numero di moli n PV=nKT e indicando con il nuovo simbolo R la costante K PV=nRT e ponendo n = grammi/peso molecolare PV=gRT/M e introducendo la densità d=g/V P=gRT/MV = dRT/M e ponendo M costante per un certo tipo di gas K=R/M P=KdT la pressione del gas è proporzionale alla sua densità e alla temperatura assoluta Dalla PV=KT si possono ricavare le precedenti leggi: ISOTERMA :se T=costante segue KT = k PV=k ISOCORA :se V=costante segue che K/V = k P =KT/V ……P = kT ISOBARA :se P=costante segue che K/P =k V=KT/P……V=kT nota:nel caso dei gas reali si deve usare una formula modificata da Van Der Waals che considera anche il volume proprio del gas e le deboli interazioni tra le particelle gassose Dalla formula PV=nRT considerata nelle condizioni standard si può calcolare il valore della costante generale dei gas R R = PV/nT R = 1 atmosfera*22,4 litri= 1 mole*273°K 0.082 at.litro moli.kelvin nota:il volume molare in c.n =22,4 litri dalla formula PV=gRT/M si può calcolare il peso molecolare M=gRT/PV
Scaricare