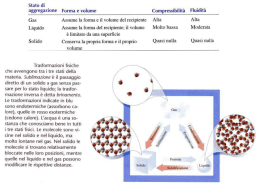
Maria Giulia Elisa Vitaly Presentano … TEORIA DEI G A S Definizione ed etimologia • Il termine gas fu attribuito dal chimico J.B. van Helmont. • I gas sono sostanze allo stato aeriforme. • Non hanno un volume proprio e quindi sono facilmente comprimibili. • La loro energia interna è prevalentemente cinetica. La legge di boyle: trasformazione di un gas a temperatura costante • Il volume V occupato da una determinata quantità di gas mantenuta a temperatura costante è inversamente proporzionale alla pressione p del gas: p V = costante In sintesi: Esempio Legge di Boyle • • • • Racchiudiamo il gas in un recipiente chiuso da un pistone mobile Immergiamo il recipiente in una miscela di acqua e ghiaccio (la miscela funziona come un termostato a 0°) Appoggiamo dei pesi sul pistone, la pressione del gas aumenta e il volume diminuisce La pressione che il gas esercita su tutte le pareti del contenitore è uguale alla pressione esercitata sul gas dall’atmosfera e dai pesi LA PRIMA LEGGE DI GAY-LUSSAC: TRASFORMAZIONE DI UN GAS A PRESSIONE COSTANTE • Quando un gas è mantenuto a pressione costante, il suo volume varia linearmente con la temperatura. Se è noto il volume v0 occupato dal gas a 0°C, il volume V del gas alla temperatura di T gradi centigradi è: V=V0 (1+αt) LA SECONDA LEGGE DI GAY LUSSAC: TRASFORMAZIONE DI UN GAS A VOLUME COSTANTE • Quando un gas è mantenuto a volume costante, la sua pressione varia linearmente con la temperatura. Se è nota la pressione P0 del gas a 0°C, la sua pressione P alla temperatura di T gradi centigradi è: P= P0(1+ αt) ESEMPIO SECONDA LEGGE DI GAY LUSSAC • Blocchiamo il pistone con una vite in modo che non si possa spostare. Se riscaldiamo il gas con la fiamma, la temperatura del gas aumenta, il volume è costretto a restare costante mentre la pressione aumenta. IL GAS PERFETTO • Soddisfa a qualunque temperatura e a qualunque pressione la legge di Boyle le due leggi di Gay Lussac. • In natura non esistono gas perfetti • Alcuni gas come idrogeno ed elio possono essere considerati praticamente perfetti per intervalli di pressione e temperatura molto grandi CARATTERISTICHE GAS PERFETTO • • Le sue particelle hanno volume nullo Le forze attrattive tra le particelle sono nulle per cui ogni particella è indipendente dalle altre. • Le collisioni tra le particelle del gas o tra le particelle del gas e le pareti del recipiente sono perfettamente elastiche. • L'energia cinetica media delle particelle aumenta all'aumentare della temperatura assoluta del gas. EQUAZIONE DI STATO DEI GAS PERFETTI Mette in relazione per un dato numero n di moli di gas, la pressione p, il volume V e la temperatura assoluta T nella forma pV=nRT in cui R=8.3 J è la costante universale dei gas. I gas reali sono assimilabili a gas perfetti quando sono lontani dalla condensazione.
Scaricare