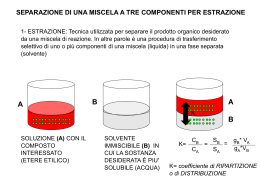
Laboratorio di chimica classi prime Estrazione con solvente SCOPO: Estrarre mediante cicloesano lo iodio da una soluzione idroalcolica L’estrazione con solventi si basa sulla diversa affinità che ha un soluto rispetto a due solventi diversi. Il solvente estraente deve essere scelto in modo che non sia miscibile né reagisca col primo e che abbia una maggiore affinità verso il soluto rispetto al primo solvente. Estrazione con solvente Procedimento: 1. Si versano 50 ml di soluzione idroalcolica di iodio nell’imbuto separatore. Questa soluzione è di colore giallo bruno. 2. Si aggiungono 15 ml di cicloesano (incolore) 3. Si tappa l’imbuto e lo si agita per permettere l’intimo contatto fra i due solventi 4. Di tanto in tanto si capovolge l’imbuto e si apre il rubinetto per sfiatare (tale operazione è da effettuarsi possibilmente sotto cappa) 5. Si lasciano decantare le soluzioni appoggiando l’imbuto separatore al sostegno: la fase acquosa, essendo di maggiore densità, si trova nella parte bassa del recipiente, mentre quella organica in alto. 6. Dopo aver stappato l’imbuto, agendo sul rubinetto sottostante, si separa la fase acquosa raccogliendola in un becher 7. Si raccoglie la fase organica in una beuta versandola dal collo dell’imbuto separatore. 8. Si versa nuovamente nell’imbuto separatore la fase acquosa. 9. Si ripetono per altre due volte i passaggi da 2 a 8 raccogliendo le porzioni organiche nella medesima beuta. Estrazione con solvente Osservazioni o La soluzione idroalcolica iniziale si presenta di colore giallo bruno piuttosto carico o Il cicloesano puro è incolore o Alla prima estrazione si nota già che la soluzione acquosa risulta molto più chiara, mentre la fase organica assume una colorazione fucsia, indice del passaggio dello iodio in questa fase. o Le successive estrazioni portano alla completa decolorazione della fase acquosa. oCon la stessa quantità di solvente, 2 separazioni successive hanno dato una maggiore resa di separazione rispetto ad una sola separazione globale. Per separare un soluto da una soluzione mediante estrazione con solvente, una volta scelto il solvente estraente e la quantità da utilizzare, porta a maggiore rese effettuare più estrazioni con piccole quantità di solvente piuttosto che una sola estrazione con tutto il solvente preventivato. Cromatografia E’ una tecnica che permette di separare i componenti di una miscela omogenea sfruttando la loro diversa velocità di spostamento su un solido, la fase fissa, quando vengono trascinati da un eluente, la fase mobile. La fase fissa può essere una striscia di carta porosa (cromatografia su carta), o una colonna di vetro riempita con ossido di alluminio (cromatografia su colonna). Le particelle delle diverse sostanze vengono adsorbite dalla superficie del solido con forze di diversa entità e perciò saranno trattenute in maniera diversa. Al passaggio dell’eluente, esse verranno trascinate con velocità diversa, per cui si separeranno formando degli strati diversamente colorati. Cromatografia Cromatografia su colonna eluente miscela di quattro sostanze ossido di alluminio Cromatografia La cromatografia su carta fase fissa carta cromatografica linea di partenza fase mobile Cromatografia INTRODUZIONE AI METODI CROMATOGRAFICI DI ANALISI Le tecniche cromatografiche permettono la separazione e quantificazione dei componenti di matrici complesse e trovano quindi numerosissime applicazioni in campo ambientale Nei metodi cromatografici i componenti di una miscela si separano distribuendosi tra due fasi: •una fase stazionaria (un solido o un liquido su supporto solido inerte) •una fase mobile (gas o liquido) che fluisce in modo continuo su quella stazionaria. La separazione è dovuta principalmente alle relative affinità per la fase stazionaria. Nella cromatografia liquida (LC) la fase mobile è un liquido, nella gas cromatografia (GC) la fase mobile è un gas. Cromatografia PRINCIPI TEORICI DELLA CROMATOGRAFIA Esempio: separazione di un campione a tre componenti in una colonna chiusa. La fase stazionaria consiste di particelle solide porose contenute all’interno di un tubo lungo e sottile (colonna). Nel passaggio attraverso la colonna ogni componente X si distribuisce fra la fase stazionaria (s) e la mobile (m): Filtrazione Filtrazione → è un’operazione in cui una fase solida insolubile di una sospensione solido-liquida è separata dalla fase liquida Principi separazione meccanica; la sospensione viene fatta passare attraverso una membrana o un setto poroso che ritiene le particelle solide sulla superficie superiore o all’interno di esso. La fase liquida che passa attraverso la membrana è detta filtrato, la membrana mezzo filtrante e la fase solida separata retinato. Il flusso del filtrato può essere dovuto : solo all’azione della gravità; si può applicare una pressione maggiore della pressione atmosferica al di sopra del mezzo filtrante (filtrazione sotto pressione) si può operare sotto vuoto. Filtrazione La filtrazione separa i componenti della miscela eterogenea solido-liquido, utilizzando un materiale poroso, di solito carta da filtro, sfruttando la diversa dimensione delle particelle. Il solido viene trattenuto dalla carta, il liquido riesce a passare. La carta da filtro va piegata due volte, arrotolata a cono e allargata. Filtrazione sospensione liquido filtrato Distillazione La distillazione semplice permette di separare i componenti di una miscela omogenea sfruttando la loro diversa volatilità e quindi la loro diversa temperatura di ebollizione. Il componente più volatile diventa vapore per primo, e giunge ad un dispositivo raffreddato con l’acqua, il refrigerante, dove subisce un secondo passaggio di stato, la condensazione, e quindi si raccoglie come liquido puro nel recipiente di raccolta. Distillazione Separazione dei componenti di una miscela omogenea (soluzione) termometro uscita acqua condensatore ingresso acqua vapore soluzione calore distillato L’apparecchio per la distillazione semplice è costituito da un pallone, un termometro, un refrigerante, una beuta di raccolta, un bunsen
Scaricare