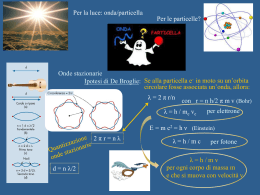
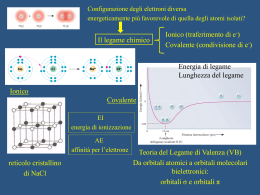
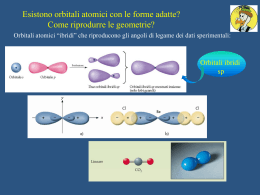
Esempi di orbitali per l'atomo di idrogeno dove maggiore luminosità significa maggiore probabilità di trovare l'elettrone (in sezione) : Orbitale s Orbitale dxy orbitali p orbitaledyz Orbitale dxz Orbitale dx2y2 Orbitale dz2 Nel complesso l'atomo dovrebbe apparire in questo modo Negli atomi polielettronici si applica una soluzione approssimata dell’equazione di Schrodinger. L’atomo viene descritto con gli stessi orbitali indicati come ns, np, nd e all’aumentare della carica nucleare Z diminuisce la distanza dell’elettrone dal nucleo e diminuisce l’energia dell’orbitale. Negli atomi polielettronici superfici limite degli orbitali + contratte perchè disposte più vicine al nucleo All’aumentare del numero di elettroni si abbassano i corrispondenti livelli energetici in modo differente per i diversi orbitali in funzione della carica nucleare, cioè del numero atomico. Principi che regolano il riempimento degli orbitali atomici : a) Il principio di esclusione di Pauli secondo il quale gli elettroni di un atomo non possono essere caratterizzati dagli stessi numeri quantici, pertanto ogni orbitale può accogliere al massimo 2 elettroni con spin antiparalleli. b) il principio della massima molteplicità di Hund secondo il quale gli elettroni tendono a collocarsi con spin paralleli nel massimo di orbitali disponibili piuttosto che disporsi a 2 a 2 nel minimo numero di orbitali, il motivo è dovuto alla repulsione elettrostatica che rende la 1ª configurazione fattibile con energia minore. Questo naturalmente ha senso laddove si è in presenza di orbitali degeneri cioè con lo stesso livello energetico. Aufbau Inserimento a uno a uno degli e- negli orbitali di E via via crescente tenendo conto dei due principi precedenti Si realizza così un sistema di minima energia chiamato stato fondamentale di un atomo Disposizione dei sottolivelli di energia degli elettroni secondo l’ordine crescente di energia Fino al numero atomico 18 (argon) si riempiono gli orbitali 3s e 3p. Per il K (Z=19) e il Ca (Z=20) dopo il 3p6 si riempie il 4s. Poi inizia la prima serie di transizione caratterizzata dal riempimento ritardato degli orbitali 3d. Ad esempio, per il Cr (Z= 24) si ha 3d54s1 e non 3d44s2 in quanto si rivelano stabili le configurazioni contenenti orbitali pieni e semipieni. •Le energie degli elettroni 4s sono minori di quelle dei 3d nella fase iniziale del riempimento, a causa della loro maggiore penetrazione verso il nucleo rispetto ai 3d. •Con l’aumentare di Z (da Z=21) che esercita un effetto di contrazione maggiore sugli orbitali esterni 3d che non sull’orbitale 4s, le capacità penetranti di quest’ultimo diminuiscono e aumenta l’influenza di n nel determinare l’energia del sistema. I dieci elementi più abbondanti sulla crosta terrestre: Ossigeno, Silicio, Alluminio, Idrogeno, Sodio, Ferro, Magnesio, Calcio, Zolfo, Potassio, Titanio. Silicio, ossigeno e alluminio sono i costituenti fondamentali della crosta terrestre formando composti detti silicati Elementi nel corpo umano: Idrogeno, Ossigeno, Carbonio, Azoto, Calcio, Zolfo, Fosforo, Sodio, Potassio, Cloro, Magnesio, Ferro, Zinco, Rame, Stagno, Manganese, Iodio, Molibdeno, Cobalto, Vanadio. Gli esseri viventi, uomo compreso, sono formati da composti del carbonio: proteine, zuccheri, grassi, acidi nucleici. Elementi dei gruppi rappresentativi Elementi di transizione La linea rossa divide i metalli (in basso a sinistra) da i non metalli (in alto a destra) Elementi biologicamente importanti ed elementi altamente tossici Elementi molecolari e loro stati fisici a T ambiente Aumenta Z Aumenta n Energia di ionizzazione (I)= energia da somministrare perché un atomo gassoso isolato perda un elettrone esterno dando uno ione positivo Può esistere una prima (I1) ed una seconda (I2) energia di ionizzazione, dove I2> I1 I valori + alti di I li hanno i gas nobili, i più bassi i metalli del gruppo 1, che colpiti da radiazioni luminose possono emettere eAffinità elettronica = energia liberata da un atomo neutro gassoso isolato quando acquista un elettrone dando uno ione negativo Aumenta la carica Nell’ambito dei periodi, l’affinità elettronica nucleare e diminuisce il cresceatomico per raggiungere il massimo per gli raggio alogeni. Nell’ambito dei gruppi, l’affinità elettronica diminuisce dall’alto verso il basso perché gli elettroni vengono addizionati a distanze sempre maggiori dal nucleo per cui l’attrazione diminuisce Gli elementi che hanno tendenza a perdere elettroni di valenza per dare ioni positivi (elementi elettropositivi) cioè hanno basse energie di ionizzazione sono metalli. Gli elementi elettronegativi con alta affinità elettronica sono non metalli. Gli elementi con carattere intermedio sono semimetalli Elettronegatività Tendenza di un atomo ad attirare verso se gli elettroni che condivide con un altro atomo a cui è legato
Scaricare