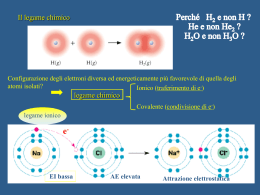
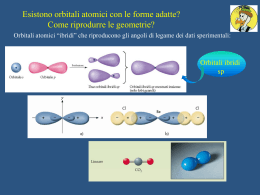
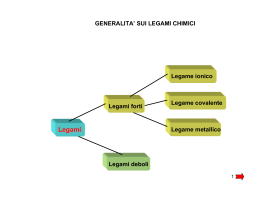
Configurazione degli elettroni diversa energeticamente più favorevole di quella degli atomi isolati? Il legame chimico Ionico (traferimento di e-) Covalente (condivisione di e-) Energia di legame Lunghezza del legame Ionico Covalente EI energia di ionizzazione AE affinità per l’elettrone reticolo cristallino di NaCl Teoria del Legame di Valenza (VB) Da orbitali atomici a orbitali molecolari bielettronici: orbitali σ e orbitali π Legame σ orbitali σ Legami multipli N2 orbitali π Legame π σ π π COME SONO FATTE LE MOLECOLE? La teoria del VB descrive ogni legame singolarmente come coppie di elettroni condivise e “localizzate” tra i due nuclei interessati al legame Metodo VSEPR (Valence Shell Electron Pair Repulsion) coppie condivise o non = zone ad elevata densità elettronica ↓ Forti repulsioni ↓ Geometrie compatibili con il contenuto energetico più favorevole 1. atomo meno elettronegativo come atomo centrale 2. Spaiare elettroni del guscio di valenza dell’atomo centrale 3. accoppiare gli e- nei legami (bp) e in coppie solitarie (lp) quelli che restano 4. contare le coppie di e- (σ-bp e lp) 5. assegnare la geometria 6. distorsione delle geometrie: lp-lp > lp-bp > bp-bp Distorsione delle geometrie Come riprodurre le geometrie? Quali orbitali atomici hanno la forma adatta? Orbitali atomici detti “ibridi” che riproducono gli angoli di legame dei dati sperimentali sp sp2 sp3d sp3d2 sp3 Il carbonio e la chimica organica etano C2H6 metano CH4 sp3 -2H sp3 sp2 etene o etilene C2H4 - 2H sp etino o acetilene C2H2 molecole paramagnetiche: Risonanza specie radicaliche: Teoria degli Orbitali Molecolari (M.O.) Invece di descrivere la coppia di elettroni condivisa e localizzata tra i due nuclei (VB) si ridistribuiscono TUTTI gli elettroni su orbitali molecolari estesi a tutti i nuclei della molecola; da n orbitali atomici si ottengono n orbitali molecolari, leganti e antileganti, con split di energia rispetto a quella degli orbitali atomici di partenza e con ordine di legame = (neleganti – neantileganti) / 2 I composti aromatici: il benzene C6H6 Così, per descrivere il legame di molecole poliatomiche: con O.M. delocalizzati con O.M. localizzati ↓ legami σ ↓ geometria ↓ legami π ↓ Sistemi coniugati
Scaricare