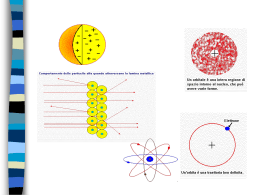
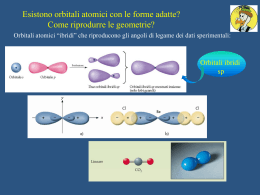
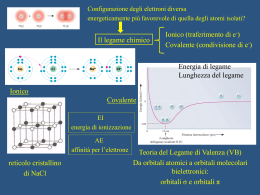
Bilancia di Gouy: Serve ad identificare il comportamento paramagnetico delle molecole La molecola dell’ossigeno viene attratta da un campo magnetico: quindi è paramagnetica (ha uno o più elettroni spaiati) Perché la molecola di ossigeno è paramagnetica ? Dove sono gli elettroni spaiati ? 2p 2s Config. Elettr.: 1s2, 2s2, 2p4 O=O Modello secondo la teoria del VB Modello secondo la teoria dell’ibridazione (sp2) TEORIA DEGLI ORBITALI MOLECOLARI LCAO Il metodo degli OM è in effetti più adeguato al reale. Anche per gli OM si definiscono delle funzioni d'onda Y che descrivono gli elettroni nella molecola. Y è detto orbitale molecolare (ricordiamo che y, minuscolo, rappresenta l'orbitale atomico). Ogni Y avrà, come y, dei numeri quantici, legati alla forma e all'energia E dell'orbitale; potremo così individuare orbitali molecolari s, p, d ... (in analogia con i nomi degli OA, che avevamo chiamato s, p, d, f...). Il metodo di assegnazione degli elettroni è analogo a quello dell'aufbau usato per gli OA. La funzione Y2dt misura la probabilità di trovare l'elettrone nell'elemento di volume dt (y2dt la misura nel caso degli OA). Anche Y come y, è ottenibile per risoluzione dell'equazione d'onda di Schrödinger, in modo più o meno approssimato, date le difficoltà di risoluzione rigorosa. Una prima approssimazione di calcolo è quella che si chiama L.C.A.O. (Linear Combination of Atomic Orbitals): le varie Y sono perciò considerate come combinazioni lineari delle y degli OA. Se abbiamo due funzioni d'onda yA e yB per i due atomi A e B, potremo allora avere: OM leganti (bonding) Yb= yA+ yB OM antileganti (antibonding) Ya= yA- yB Il numero di OM è eguale al numero complessivo di OA di valenza. Regole di combinazione degli orbitali atomici, legami s e p secondo la teoria L.C.A.O. 1. Si possono combinare solo orbitali che possiedono energie non troppo diverse tra loro. 2. Le superfici di inviluppo devono sovrapporsi il più possibile (criterio della massima sovrapposizione). Solo gli orbitali atomici più esterni possono combinarsi. 3. Si possono combinare solo gli orbitali che presentano la stessa simmetria rispetto all’asse di legame. Es.: (s)A (s)B ; (s)A (px)B ; (px)A (px)B ; (py)A (py)B Ma non (px)A (pz)B Se la combinazione tra gli OA coinvolge quelli con simmetria cilindrica rispetto all’asse di legame si ottengono orbitali molecolari di tipo s (e s*); se gli OA non hanno simmetria cilindrica si ottengono OM di tipo p (e p*). OM con elettroni spaiati che conferiscono proprietà paramagnetiche alla molecola Ordine di legame (n° dei normali legami covalenti): [n° di e- in OM di legame (s e p)] - [n° di e- in OM di antilegame (s* + p*)] 2 FORMAZIONE DEI RADICALI LIBERI DELL’O2 (ROS) O2 + e- Ossigeno molecolare n =(8-4)/2= 2 O2Ione superossido (8-5)/2= 1.5 + e- O22- OH- + e- Ione ossidrile Ione perossido (8-6)/2= 1 OH• Radicale ossidrile (8-7)/2= 0.5 O=O O2 Ossigeno molecolare O2 - O Ione perossido O O Ione superossido O22- • • • O O • O O • O O • O O H Ione ossidrile H • O Radicale ossidrile C CO
Scaricare