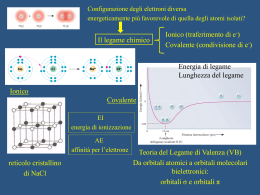
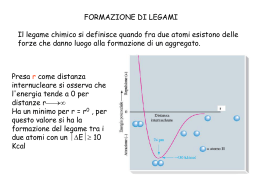
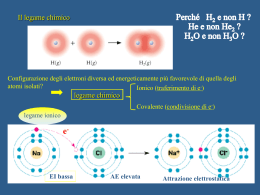
Il comportamento di una sostanza può essere interpretato in maniera completa solo se si conosce anche la natura dei legami che tengono uniti gli atomi. Esempio degli ISOMERI CH3CH2OH CH3-O-CH3 ma la formula bruta è la stessa C2H6O Le teorie sul legame chimico (ionico, covalente e metallico) si basano su: •Legge di Coulomb (bilanciamento forze elettriche) •Meccanica quantistica movimento degli e-) (posizione e Nei vari tipi di legame sono coinvolti gli e- esterni detti elettroni di valenza LEGAME IONICO E’ un legame di natura elettrostatica che si forma tra due elementi aventi rispettivamente - una bassa energia di ionizzazione -un’alta affinità elettronica. Es. NaCl Composti con legami ionici Nei cristalli ionici non sono presenti molecole ben definite, ma un numero grande di ioni presenti in un dato rapporto I composti ionici non sono molti. Quasi tutti i composti conosciuti presentano un legame in cui gli atomi sono legati tra loro in modo da raggiungere una configurazione più stabile, a minore energia, mettendo in compartecipazione coppie di elettroni Legame covalente dovuto alla condivisione tra 2 atomi di 1 o + coppie di e- in modo che ciascun atomo raggiunga la configurazione di un gas nobile. Le coppie elettroniche si formano per accoppiamento di elettroni spaiati. TEORIA A COPPIA DI ELETTRONI (teoria di Lewis) La teoria si basa sull’ipotesi avanzata da Lewis nel 1916 secondo cui il legame covalente è dovuto alla condivisione di elettroni tra due atomi di una o più coppie di elettroni in modo che ciascun atomo raggiunga la configurazione di gas nobile LEGAME COVALENTE POLARE Momento di dipolo: Prodotto della carica per la distanza La risultante dei momenti di dipolo dei singoli legami nella molecola ne determina la polarità o apolarità. Polarità delle molecole TEORIA VSEPR: VALENCE SHELL ELECTRON PAIR REPULSION La disposizione geometrica dei legami intorno a un atomo dipende dal numero totale di coppie elettroniche, di legame e solitarie, che lo circondano. Tali coppie si dispongono nello spazio in modo da minimizzare la loro mutua repulsione. Geometria molecolare VSEPR Due modi per mostrare la geometria della molecola NH3 Due modi per mostrare la geometria della molecola di H2O Alcune molecole o ioni (es. O3, SO2, ione NO3-, benzene) Possono essere rappresentate da strutture in risonanza Differiscono per la disposizione degli e Sono strutture limite o canoniche ma che concorrono alla rappresentazione della struttura reale TEORIA DEL LEGAME DI VALENZA (VB) Interpreta il legame chimico in termini di meccanica ondulatoria e si basa sul concetto di Lewis secondo il quale gli atomi si legano per condivisione di coppie di elettroni. Si può determinare una funzione d’onda ψcov che descrive il comportamento degli elettroni occupanti, a spin antiparallelo, una stessa regione dello spazio tra due nuclei. Condizioni: - gli orbitali atomici che si sovrappongono devono avere la stessa energia; - ognuno dei due atomi deve contribuire con orbitali atomici che descrivono un solo elettrone; - la direzione di massima sovrapposizione degli orbitali corrisponde alla direzione del legame. Legami σ e π nella molecola di N2 La teoria degli orbitali ibridi rappresenta un trattamento più avanzato rispetto alla teoria VSEPR che prevede la geometria della molecola senza tenere conto delle energie dei legami (es. BeH2). L’ibridizzazione non è un fenomeno fisico reale ma è un metodo matematico (combinazione lineare) che permette di ottenere per un atomo nuovi orbitali che presentano, rispetto agli orbitali atomici puri da cui sono ottenuti, zone di probabilità in direzioni dello spazio che concordano con le direzioni dei legami, osservate sperimentalmente o previste con la teoria VSEPR TEORIA DELL’ORBITALE MOLECOLARE (MO) Assegna gli elettroni di una molecola a una serie di orbitali, detti orbitali molecolari che appartengono all’intera molecola e vengono ordinati secondo energie crescenti secondo il principio di Pauli e la regola di Hund. Come gli orbitali atomici sono funzioni matematiche che descrivono il comportamento di un elettrone in un atomo così gli orbitali molecolari descrivono il comportamento di un elettrone nella molecola. Gli orbitali molecolari si ottengono con un procedimento matematico di combinazione lineare degli orbitali atomici. ORDINE DI LEGAME= elettronilegame elettroniantilegame 2 Legame metallico Tipico di elementi a bassa I che hanno le proprietà: •Elevata conducibilità termica ed elettrica •Buona duttilità e malleabilità •Struttura compatta •Opacità e lucentezza Legame e proprietà interpretabili con la teoria delle bande: Se la teoria MO viene applicata a un numero N grande di atomi si ottengono N orbitali molecolari a energia ravvicinata con infittimento di livelli da generare una banda praticamente continua Vi sono tante bande quanti sono gli orbitali atomici negli atomi isolati a dare la banda di valenza Se le energie degli orbitali di partenza sono molto diverse le bande di energia rimangono separate se vicine si sovrappongono Per la conduzione elettrica occorre che la banda di valenza che si sovrappone a quella sottostante (banda di conduzione) sia solo parzialmente occupata in modo che gli elettroni eccitati termicamente o elettricamente possano facilmente passare ai livelli energetici vuoti. Colore dei metalli assorbimento di radiazioni luminose diverse perché diverso può essere il DE tra ultimo livello occupato e primo livello libero. Nei metalli gli elettroni di valenza non appartengono al singolo atomo ma a tutto il cristallo metallico cioè sono delocalizzati come un “mare di elettroni” che circonda gli ioni metallici positivi. I legami deboli FORZE DI VAN DER WAALS Forze dipolo-dipolo Forze dipolo-dipolo indotto Forze dipolo istantaneo-dipolo istantaneo o di London Legame a H nell’acqua Struttura aperta del ghiaccio con legami a H direzionali Catena di legami a H in HF Struttura a strati di B(OH)3 che permette alla sostanza di essere solida a T ambiente e struttura lamellare che riflette la luce Legame a H intramolecolare
Scaricare