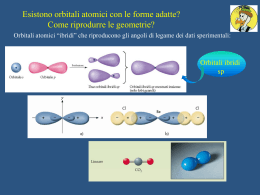
FORMAZIONE DI LEGAMI Il legame chimico si definisce quando fra due atomi esistono delle forze che danno luogo alla formazione di un aggregato. Presa r come distanza internucleare si osserva che l'energia tende a 0 per distanze r Ha un minimo per r = r0 , per questo valore si ha la formazione del legame tra i due atomi con un E 10 Kcal A seconda delle proprietà dei singoli elementi, il legame si può formare attraverso diversi meccanismi: • Trasferimento di elettroni da un atomo all'altro • Messa in comune di elettroni • Messa in comune di coppie di elettroni Per realizzare il legame è necessario che gli elettroni impegnati abbiano spin antiparalleli. I legami chimici sono caratterizzati da tre parametri: Energia di legame Distanza di legame Angolo di legame (nel caso di tre atomi) Legame Energia di legame Distanza Kcal/mole in Å HH 104 0,75 OH 0,96 HF 135 0,92 HCl 103 1,27 HBr 88 1,41 HI 71 1,61 OO 119 1,20 NN 225 1,09 Il legame si forma tra due atomi che avvicinandosi arrivano ad una distanza in cui non si attraggono e non si respingono. Si sovrappongono formando una zona di maggiore densità elettronica e minore energia. CLASSIFICAZIONE DEI LEGAMI LEGAMI ATOMICI: Legame covalente Legame omopolare Legame dativo Legame con elettroni delocalizzati LEGAMI ELETTROSTATICI: Legame ionico LEGAMI DIPOLARI LEGAME IDROGENO LEGAME METALLICO Il legame può essere simboleggiato con un tratto o con due punti (elettroni messi in comune) LEGAME COVALENTE OMOPOLARE Tra due atomi uguali, non e' polarizzato Cl Cl + Cl Cl Cl .. Cl LEGAME COVALENTE POLARE Si forma tra due atomi diversi , in questo caso il doppietto si trova più vicino all'atomo più elettronegativo; si forma quindi un dipolo che viene rappresentato con una parziale suddivisione + di carica (+ ) HF ●● ●● :Cl:Cl: ●● ●● LEGAME DATIVO Si forma tra due atomi che possiedono nello stato fondamentale o in uno stato eccitato: a) una coppia elettonica (datore) b) un orbitale vuoto (accettore) OH OH S O O LEGAME CON ELETTRONI DELOCALIZZATI Si forma in presenza di orbitali di uguale simmetria che contengono elettroni spaiati, questi vengono delocalizzati su tutta la molecola. LEGAMI ELETTROSTATICI Legame ionico Per valori molto diversi di elettronegatività si formano ioni (+) e ioni(). Si formano quindi macromolecole, in questo processo si libera energia proporzionale alla distanza tra gli ioni denominata energia reticolare. LEGAMI DIPOLARI Detti anche legami di van der Waals, si formano in presenza di: Le forze dipolo istantaneo-dipolo indotto ( forze di dispersione di London) si formano a causa di sbilanciamenti temporanei della carica nella molecola che causa uno sbilanciamento nelle molecole adiacenti. Questo fenomeno diminuisce all'aumentare della distanza tra le molecole e aumenta con l'aumento del numero di elettroni. Si spiega con questo, ad esempio, l'aumento della t.e. scendendo lungo il 7° gruppo. ione / dipolo; ione / dipolo indotto; dipolo / dipolo; dipolo /dipolo indotto CH3COCH3 C2S H H O H H K + O H O H LEGAME IDROGENO Si forma in molecole in cui H è legato ad atomi fortemente elettronegativi. In questo modo l’H viene protonizzato e lega con legame elettrostatico un altro atomo elettronegativo. CH3 C O C OH Legami H + CH3 C O C O H O C H O C CH3 H2S PH3 P 3p2 3s2 H 1s1 Molecola di O2 π O px py pz σ px py O pz 2p4 2p4 2s2 2s2 Molecola di N2 π σ N px py pz π px py N pz 2p3 2p3 2s2 2s2 Nella teoria dei legami di valenza, quando i legami vengono descritti, si tiene conto della parziale sovrapposizione degli orbitali atomici degli elementi interessati. Da una prima analisi, le strutture di alcune molecole non potrebbero essere giustificate. Ad esempio descrivere la molecola di H2Be non è possibile utilizzando gli orbitali puri del Be 1s2 2s2, la molecola può essere descritta utilizzando orbitali ibridi. Il processo di formazione degli ibridi si spiega con una prima fase in cui si ha PROMOZIONE di un elettrone nell’orbitale libero dello stesso guscio; nel caso del Be dal 2s2 si ha (2s1) (2p1) IBRIDIZZAZIONE dalla combinazione di due orbitali prendono origine due orbitali ibridi equivalenti sp Formazione di orbitali ibridi sp Be 2s2 Promozione hν (sp)1 (sp)1 Be ibridizzazione H2Be Ibridizzazione sp2 2p1 B 2s2 Prom. Ibrid. (sp2)1 (sp2)1 (sp2)1 In questo caso vengono coinvolti un orbitale s e due p. Gli angoli tra i tre orbitali ibridi sono di 120°, la molecola è planare, come nel caso precedente gli orbitali sono isoenergetici. Ibridiz. Ibridizzazione sp3 C (2s2) (2p2) Prom. 2s1 2p3 Ibridiz. (sp3)1(sp3)1(sp3)1(sp3)1 CH4 Questo tipo di ibridizzazione coinvolge un orbitale s e tre orbitali p, si formano quindi 4 orbitali ibridi equivalenti posti lungo 4 assi che partono dal centro di un tetraedro e passano per i vertici formando tra loro angoli di 109.5°.
Scaricare