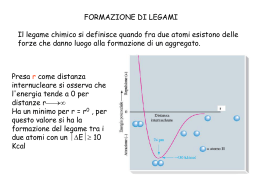
Chimica organica Composti del carbonio ridotto Vengono sintetizzati sulla Terra dagli organismi Si trovano anche nello spazio Il primo composto organico a essere sintetizzato in laboratorio –1828- fu l’urea dal chimico tedesco Wohler La chimica del carbonio Il carbonio appartiene al periodo 2, gruppo IV elettronegatività 2,5 ha 4 elettroni periferici, 2s2,2p2 che possono distribuirsi 2s1,2p3 cioè un elettrone passa dall’orbitale s a un orbitale p Gli orbitali risultano ibridi e formano tra loro un angolo di 109° Legato a 4 atomi di idrogeno dà una molecola tetraedrica (CH4 metano) Il carbonio legato all’idrogeno (elettronegatività 2,1) si dice ridotto Molecola tetraedrica CH4 metano legami e legame chimico attrazione elettrostatica tra nuclei e doppietti elettronici con formazione di orbitali molecolari sovrapposizione parziale di orbitali atomici laterale la congiungente dei due nuclei legame singolo perpendicolare alla congiungente legame doppio 2 orbitali s 1 orbitale s 1 orbitale p triplo 2 orbitali p ibridazione Il legame chimico provoca l’ibridazione degli orbitali s e p Ibridazione dell’orbitale s con gli orbitali ibridi gli orbitali p. diversa orientazione 3 orbitali p ibridazione sp3 2 orbitali p ibridazione sp2 1 orbitale p ibridazione sp formano solo formano nuova forma legami legami perpendicolari al piano dei legami Geometria degli orbitali ibridi .- 4 orbitali sp3 4 legami a 109° tetraedro - 3 orbitali sp2 1 orbitale p 3 legami a 120° complanari 1 legame - 2 orbitali sp 2 orbitali p 2 legami a 180° complanari 2 legami VSEPR Valence Shell Electron Pair Repulsion geometria delle molecole definita dai doppietti elettronici doppietti repulsione su non impegnati in legame 2 ibridi sp3 H2O angolata 105° tra H. doppietti di legame 1 NH3 piramide 107° tra H stessa formula molecolare ma diversa distribuzione di atomi ISOMERIA C di catena C C C C C C C C C C C H STRUTTURALE O di posizione C C C C C C C C O —C—C—C—C—O—H —C—C—O—C—C—H di gruppo funzionale Sfalsata Conformazionale Eclissata STEREOISOMERIA (spaziale) enantiomeri Ottica cis GEOMETRICA trans trans cis H Isomeria ottica 2 isomeri specularmente uguali - non sovrapponibilienantiomeri C* asimmetrico Distinti per il verso di deviazione legato a quattro atomi della luce polarizzata o gruppi diversi destrogiro levogiro I sistemi biologici sintetizzano solo La sintesi artificiale produce entrambi gli enantiomeri Miscela racemica Metano, etano e legami Metano: 4 legami tra 4 orbitali ibridi di C orbitali s di H etano 1 legame tra i 2 atomi di carbonio Etano C2H6: gli atomi C possono ruotare sull’asse del legame che li unisce passando dalla forma eclissata a quella sfalsata Etene e legami ibridi sp2 1 1 I 2 atomi C sono uniti da un doppio legame I legami multipli non permettono la rotazione degli atomo C e per passare dalla forma cis a quella trans occorre rompere e riformare i legami diastereoisomeri cisbutene transbutene
Scaricare