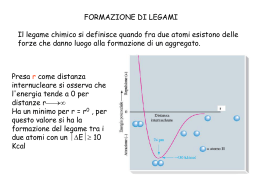
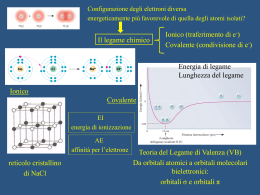
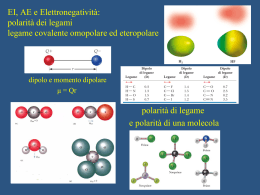
Esistono orbitali atomici con le forme adatte? Come riprodurre le geometrie? Orbitali atomici “ibridi” che riproducono gli angoli di legame dei dati sperimentali: Orbitali ibridi sp Orbitali ibridi sp2 Orbitali ibridi sp3 Orbitali ibridi sp3d Orbitali ibridi sp3d2 Il carbonio e la chimica organica etano C2H6 metano CH4 sp3 -2H sp3 sp2 etene o etilene C2H4 - 2H sp etino o acetilene C2H2 Risonanza Ione carbonato CO3-- Ibrido di risonanza benzene C6H6 Elettronegatività Tendenza di un atomo ad attrarre verso di sé gli elettroni impegnati nel legame Legame covalente omeopolare ed eteropolare polarità di una molecola Non si misura ma si può calcolare a seconda della definizione che ne viene data Mulliken propose di calcolarla come media aritmetica dei valori di EI ed AE dell’elemento considerato Pauling costruì una scala relativa in base ai valori sperimentali delle energie di legame di molecole biatomiche, scegliendo un valore di riferimento dipolo momento dipolare μ = Qr polarità dei legami Legami intermolecolari natura elettrostatica molto più deboli dei legami covalenti Legame idrogeno Forze di van der Waals ione - dipolo dipolo - dipolo dipolo – dipolo indotto dipolo istantaneo-dipolo indotto (forze di dispersione di London) Tra atomo H fortemente polarizzato (H-F, H-O, H-N, con intensità decrescente) E un atomo fortemente elettronegativo H2O! DNA! L’appaiamento obbligatorio di A con T e di C con G rende i due filamenti fra loro complementari: se uno di essi presenta la sequenza C-T-A-C-G, l’altro non potrà che avere la sequenza complementare G-A-T-G-C. Un filamento costituisce quindi una sorta di stampo per l’altro. Stato di ossidazione degli elementi Nel legame cambia la distribuzione elettronica. Come sono ripartiti tra i vari atomi gli elettroni impegnati nei legami? Struttura ionica la ripartizione è netta! NaCl: Na+ +1 Cl- -1 Struttura covalente omeopolare: no separazione di carica eteropolare: separazione di carica Numero di ossidazione Carica netta di uno ione (legame ionico) Carica che avrebbe l’elemento se il legame fosse ionico n.o. max: gruppo di appartenenza (n.max di e- che può donare) n.o. min: n.max di e- che può acquistare per completare l’ottetto Anche n.o. frazionari Regole 1. Ogni atomo nello stato elementare: n.o. = 0 2. Ogni ione monoatomico: n.o. = carica 3. idrogeno: n.o. = +1 sempre tranne negli idruri (-1) 4. ossigeno: n.o. = -2 sempre tranne nei perossidi (-1) 5. Aggregato poliatomico: la somma dei n.o. deve essre uguale alla carica complessiva dell’aggregato, o uguale a zero se l’aggregato è neutro. 6. Più atomi uguali nella stessa molecola: n.o. medio Bilanciamento rezioni redox Nelle reazioni si ha spesso un riarrangiamento degli atomi e quindi una ridistribuzione degli elettroni di legame tra gli atomi ↓ cambiamento n.o. degli elementi X + e- → Xn.o. di X da 0 a -1 riduzione Y → Y+ + en.o. di Y da 0 a +1 ossidazione X / X- e Y / Y+ sono due coppie redox Nella reazione X + Y → X- + Y+ si ha un trasferimento di elettroni da Y (che si ossida) ad X (che si riduce) (anche se il trasferimento non è netto!)
Scaricare