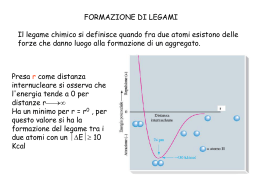
Le teorie sul legame chimico (ionico, covalente e metallico) si basano su: •Legge di Coulomb (bilanciamento forze elettriche) •Meccanica quantistica (posizione e movimento degli e-) Nei legami chimici sono coinvolti gli elettroni di valenza (periferici)! ENERGIA DI LEGAME Legame ionico di natura elettrostatica si realizza tra 2 elementi aventi una bassa I ed un’alta A I composti ionici sono duri, rigidi e fragili, hanno alte Tf e T eb, allo stato fuso sono conduttori di elettricità, si sciolgono in solventi polari nei quali possono condurre la corrente elettrica. Composti con legami ionici CARATTERISTICHE DEI COMPOSTI IONICI I composti ionici sono tutti solidi a temperatura ambiente. Hanno in genere punti di fusione elevati e punti di ebollizione ancora più elevati, per cui è difficile farli passare allo stato di vapore. Ciò indica che l’attrazione fra gli ioni è forte, per cui occorre molta energia per separarli. Caratteristiche dei composti ionici allo stato liquido Quando il composto ionico è allo stato liquido, ogni ione è circondato da ioni di segni opposto; per le caratteristiche proprie dei liquidi, gli ioni non sono vincolati a posizioni fisse, ma possono muoversi attraverso il liquido. Ciò spiega perché i composti ionici allo stato liquido sono in grado di condurre corrente elettrica. Si ha, perciò, un passaggio di corrente quando delle particelle carche si muovono. Se nel liquido si immergono due elettrodi aventi cariche di segno opposto, gli ioni positivi migrano verso l’elettrodo negativo, mentre gli ioni negativi vanno verso l’elettrodo positivo. elettrodo positivo (+) elettrodo negativo (-) + + + + + + + + + Direzione di migrazione degli ioni verso i due elettrodi immersi in un composto ionico allo stato fuso. Formazione del legame ionico nel cloruro di sodio (NaCl) 1 – L’atomo di sodio perde il suo elettrone esterno e diventa uno ione positivo. = Atomo di sodio (Na) Na Na+ + e- 2 – L’atomo di cloro acquista l’elettrone perduto dal cloro e diventa ione negativo. Cl + e- Cl- 3 – I due ioni, avendo cariche elettriche di segno opposto, si attirano e restano uniti. = Atomo di sodio (Na) = Atomo di cloro (Cl) Na+ + Cl- NaCl Nei cristalli ionici non sono presenti molecole ben definite, ma un numero grande di ioni presenti in un dato rapporto (Na:Cl, 1:1) Legame covalente dovuto alla condivisione tra 2 atomi di 1 o + coppie di e- in modo che ciascun atomo raggiunga la configurazione di un gas nobile (teoria di Lewis). Le coppie elettroniche si formano per accoppiamento di elettroni spaiati. Il legame covalente si forma fra atomi la cui differenza dei valori di elettronegatività non è maggiore di 1,7. I due atomi mettono in comune un elettrone ciascuno. Gli elettroni che vengono messi in comune sono elettroni spaiati, cioè elettroni che si trovano isolati in un orbitale. Quando i due atomi si avvicinano a sufficienza, avviene una parziale sovrapposizione dei due orbitali in cui si trovano gli elettroni spaiati: i due orbitali si compenetrano l’un l’altro per una certa regione di spazio, che apparterrà contemporaneamente ad entrambi gli orbitali e di conseguenza gli elettroni che si trovano in questi orbitali apparterranno contemporaneamente ai due atomi. Il legame covalente è il legame chimico più forte e si distinguono due tipi di legame covalente: 1 - il legame covalente puro; 2 - il legame covalente polare. Legame eteronucleare più o meno polarizzato Legame omonucleare Legame covalente omonucleare Legame covalente eteronucleare Legame covalente dativo Un legame covalente polare si forma tra atomi che hanno elettronegatività diversa, ma non tanto diversa da rendere possibile la formazione di un legame ionico (la differenza dei valori di elettronegatività è sempre minore di 1,7). I due atomi mettono in comune i loro elettroni spaiati, tramite la sovrapposizione degli orbitali in cui si trovano questi elettroni. Tuttavia la coppia di elettroni non è equamente condivisa fra i due atomi: gli elettroni passano più tempo attorno all’atomo più elettronegativo, rendendolo parzialmente negativo, mentre l’altro atomo diviene parzialmente positivo. Teoria di Lewis Teoria del legame di valenza Teoria dell’orbitale molecolare Formule di struttura I simboli di Lewis mettono in evidenza la configurazione elettronica esterna: elettroni di valenza Formule di Lewis elettroni di valenza (elettroni spaiati o spaiabili) indicati come punti e coppie elettroniche come trattini Le coppie non utilizzate nel legame (trattini) si chiamano doppietti solitari Le formule di Lewis non danno nessuna indicazione circa la disposizione spaziale o geometria dei legami Legame omonucleare Legame eteronucleare o di coordinazione Un atomo mette a disposizione una coppia elettronica e l’altro un orbitale vuoto per riceverli donatore accettore N.B.: questo tipo di legami non sono diversi dagli altri legami covalenti Una molecola biatomica contenente un legame polare è sempre polare, cioè ha un’estremità positiva e un’estremità negativa. Nel caso di molecole con più di due atomi, la situazione può essere diversa, e dipende dalla geometria della molecola e dalla somma vettoriale dei momenti dipolari associati ai vari legami polari. Possiamo considerare alcuni esempi: - la molecola dell’acqua (H2O) - la molecola del biossido di carbonio (CO2) Momento di dipolo: Prodotto della carica per la distanza La risultante dei momenti di dipolo dei singoli legami nella molecola ne determina la polarità o apolarità. La disposizione geometrica dei legami attorno ad un atomo dipende dal numero totale di coppie elettroniche (di legame e solitarie) che lo circondano Le coppie elettroniche si dispongono nello spazio in modo da minimizzare la loro mutua repulsione Geometria molecolare VSEPR La disposizione spaziale influenza il momento di dipolo della molecola m e quindi la polarità totale della molecola Due modi per mostrare la geometria della molecola NH3 Due modi per mostrare la geometria della molecola di H2O Polarità delle molecole Alcune molecole o ioni (es. O3, SO2, ione NO3-, benzene) Possono essere rappresentate da strutture in risonanza Differiscono per la disposizione degli e Sono strutture limite o canoniche ma che concorrono alla rappresentazione della struttura reale Teoria del legame di valenza Il legame chimico viene interpretato alla luce della meccanica quantistica Sovrapposizione di orbitali atomici - Gli orbitali atomici (OA) che si sovrappongono devono avere energie simili - Ognuno dei due atomi deve contribuire con OA che descrivano un solo e- (o una coppia di e- e un orbitale vuoto) - La direzione di massima sovrapposizione degli OA corrisponde alla direzione di legame La molecola N2 Geometria molecolare: orbitali ibridi (Trattazione avanzata della teoria VSEPR) • Si ottengono orbitali ibridi isoenergetici orientati lungo le direzioni dei possibili legami che l’atomo centrale può formare Teoria del VB Negli orbitali ibridi può essere alloggiata anche una coppia solitaria ibridizzazione sp3 C ibridizzazione sp2 ibridizzazione sp Teoria dell’orbitale molecolare Introdotta per spiegare le proprietà magnetiche e spettroscopiche di alcune molecole Teoria dell’orbitale molecolare (OM) Assegna gli elettroni di una molecola a una serie di orbitali, detti orbitali molecolari (OM), che appartengono all’intera molecola Gli OM sono delle funzioni matematiche che descrivono il comportamento di un elettrone in una molecola (analogamente agli OA negli atomi) Gli OM si ottengono per combinazione lineare degli OA Gli elettroni, in numero uguale al totale di elettroni degli atomi della molecola, vengono assegnati agli OM seguendo il principio di Pauli e la regola di Hund Il legame in una molecola è tanto più forte quanto più elevato è il numero di elettroni in orbitali di legame rispetto agli orbitali di antilegame Ordine di legame: (n° di e- negli orbitali di legame - n° di e- negli orbitali di antilegame)/2 Es. H2, He2, N2, O2 Legame metallico Metalli Teoria delle bande Quando la teoria OM viene applicata a un numero N grande di atomi uguali, si ottiene un numero totale N di orbitali molecolari a energia ravvicinata, talmente vicini da dar luogo a una banda praticamente continua di energia Per una mole di metallo: NA: numero di Avogadro Vi sono tante bande quanti sono i tipi di orbitali atomici negli atomi isolati; quando sono interessati gli orbitali atomici di valenza, la banda viene chiamata banda di valenza Se le energie degli OA di partenza sono molto diverse, le bande di energia rimangono ben distinte (es. 1s e 2s); se le loro energie sono vicine (es. 2s e 2p, 3s e 3p), le bande si sovrappongono costituendo un’unica banda Per avere conduzione elettrica (e termica) occorre che la banda di valenza, oppure la banda che si sovrappone a quella di valenza (se satura), sia vuota o parzialmente occupata da e-, in modo che possa costituire una banda di conduzione Es. Li Es. Be Es. Na Colore dei metalli: assorbimento di radiazioni luminose diverse perché diverso può essere il E tra ultimo livello occupato e primo livello libero (dipende dal metallo). Tutti i metalli Es. diamante Si e Ge Nei conduttori la conducibilità diminuisce con la T, nei semiconduttori aumenta Gas nobili Legame a idrogeno Interazioni dipolari: forze di Van der Waals FORZE DI VAN DER WAALS Forze dipolo-dipolo indotto Forze dipolo-dipolo Forze dipolo istantaneo-dipolo istantaneo o di London Le forze di Van der Waals sono forze che agiscono a corto raggio: E= - C/r6 Energia potenziale attrattiva caotici ben definiti Il carattere direzionale del legame H fa’ sì che H2O allo stato solido occupi un volume maggiore rispetto allo stato liquido Densità del ghiaccio: 0.9163 g/cm3 Struttura aperta del ghiaccio con legami a H direzionali Catena di legami a H in HF Legame a H nell’acido acetico Struttura a strati di B(OH)3 che permette alla sostanza di essere solida a T ambiente e struttura lamellare che riflette la luce Legame a H intramolecolare
Scaricare