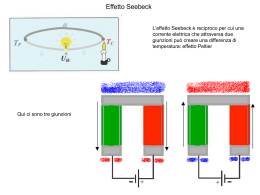
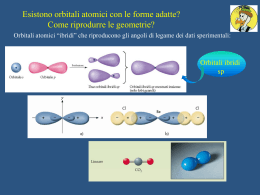
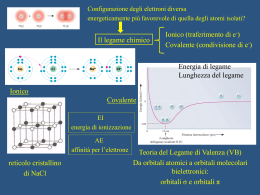
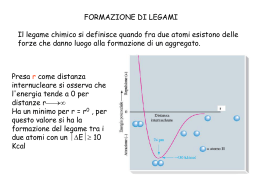
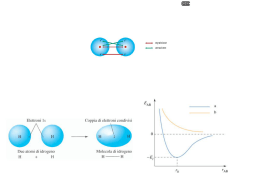
IL LEGAME COVALENTE Legame covalente Si riscontra in composti molecolari i cui atomi costituenti sono uguali o per i quali non si può avere trasferimento elettronico. H2 N2 Cl2 HCl CO in un legame covalente due atomi condividono gli elettroni di valenza o alcuni di essi. I due atomi risultano legati perchè i due nuclei attraggono simultaneamente gli elettroni condivisi. L'approccio corretto per descrivere il legame covalente è basato sulla meccanica quantistica (Heitler-London 1926). Noi vedremo solo alcuni aspetti qualitativi. E' interessante considerare come varia l'energia potenziale di una molecola biatomica in funzione della distanza fra gli atomi. Energia potenziale Ep H 0 H dl d H H L'energia potenziale è nulla quando gli atomi sono isolati (a distanza infinita) e si abbassa progressivamente quando gli atomi vengono avvicinati fino alla formazione del legame Diminuendo ancora la distanza si ha una repulsione elettrostatica fra i due nuclei positivi e l'energia potenziale torna ad aumentare. Il minimo della curva di energia potenziale rappresenta il bilanciamento tra repulsione ed attrazione. La distanza di legame è la distanza fra gli atomi nel punto di minimo. L'energia di legame è la differenza tra l’energia del sistema costituito dai due atomi isolati e del sistema in cui i due atomi si trovano alla distanza di equilibrio. In pratica è l'energia che deve essere fornita per separare gli atomi riportandoli a distanza infinita. TEORIA DI LEWIS • Quando si formano i legami chimici, gli elettroni di valenza si ridistribuiscono in modo da raggiungere le configurazioni elettroniche dei gas nobili. Questo concetto può essere applicato sia ai composti ionici che molecolari. • Quando una coppia di elettroni è condivisa tra due atomi, quella coppia occupa lo stesso strato degli elettroni di valenza di ciascun atomo e contribuisce al raggiungimento della configurazione del gas nobile per ciascun atomo. • Dal conteggio degli elettroni di valenza di ciascun atomo si può prevedere il numero di legami che l’atomo è in grado di formare. Il numero di legami è pari al numero di elettroni che devono essere condivisi per raggiungere la configurazione tipo gas nobile. ECCEZIONI ALLA REGOLA DELL’OTTETTO MOLECOLE CON MENO DI OTTO ELETTRONI DI VALENZA: BF3. La struttura di Lewis presenta solo 6 elettroni attorno all’atomo di boro. Il composto è però molto reattivo e si combina rapidamente con NH3. La coppia di elettroni solitaria dell’azoto fornisce entrambi gli elettroni condivisi in modo che sia B che N raggiungano l’ottetto (legame covalente coordinato o dativo). MOLECOLE CON PIU’ DI OTTO ELETTRONI DI VALENZA: Gli atomi del terzo periodo o dei periodi successivi possono essere circondati da più di quattro coppie di elettroni in alcuni composti perché possiedono orbitali d vuoti con energia sufficientemente bassa da ospitare gli elettroni in eccesso. Es. PF5, SF4, etc. MOLECOLE CON UN NUMERO DISPARI DI ELETTRONI DI VALENZA: Vi sono alcune molecole stabili che possiedono un numero dispari di elettroni di valenza. Tali molecole sono spesso radicali liberi a causa della presenza dell’elettrone spaiato. Es. NO (11 elettroni), NO2 (17 elettroni). LA CARICA FORMALE CARICA FORMALE: la differenza di elettroni tra l’atomo libero e quelli attribuitigli formalmente in una data formula di struttura. ATTRIBUZIONE DEGLI ELETTRONI AD UN ATOMO IN UNA DATA MOLECOLA: numero di legami che partono dall’atomo + il numero di elettroni di non legame. NUMERO DI OSSIDAZIONE: è una carica positiva o negativa che viene attribuita formalmente ad un atomo di un composto. Viene determinato dal numero di elettroni in più o in meno rispetto all’atomo neutro, quando gli elettroni di legame sono attribuiti all’atomo più elettronegativo. N=N=O N N-O N-N -1 0 +1 -1 -2 +1 +1 +1 0 O La presenza di cariche formali di segno opposto nella stessa formula viene indicata come SEPARAZIONE DI CARICA. Minore è la separazione di carica, maggiore è la stabilità della molecola. Quando la separazione di carica in due formule limite è la stessa, la formula più stabile è quella in cui la carica negativa è sull’atomo più elettronegativo. Legame covalente polare Nel caso di un legame covalente fra due atomi uguali come in H2 o Cl2 gli elettroni di legame sono equamente condivisi. Vale a dire gli elettroni hanno la stessa probabilità di trovarsi su ciascuno dei due atomi. Quando invece i due atomi sono diversi, come in HCl, gli elettroni di legame hanno maggiore probabilità di trovarsi in prossimità di un atomo piuttosto che dell'altro, e si parla di legame covalente polare. Infatti la tendenza ad attrarre gli elettroni di legame (elettronegatività) è diversa per i diversi atomi. Ad esempio per HCl gli elettroni sono maggiormente distribuiti attorno al Cl che acquista una parziale carica negativa (δ-) + H-Cl - Il legame covalente polare può essere visto come una situazione intermedia fra legame covalente non polare, (Cl2), e legame ionico (NaCl) :Cl:Cl: + H:Cl: - Na+ :Cl: Una molecola diatomica con legame covalente polare è caratterizzata da un momento dipolare non nullo. Un dipolo elettrico è costituito da due cariche elettriche -q e +q poste a distanza d. Per una tale disposizione di cariche il momento dipolare è definto come un vettore M diretto dalla carica positiva alla carica negativa e con modulo M=q·d - -q d + M=q·d +q Molecole dotate di momento dipolare sono dette polari. Una molecola quale H-Cl è polare ed ha momento dipolare: + d H-Cl - M=·d L'unità di misura del momento dipolare è il Debye (D) Nel sistema SI 1 D = 3,34 x 10-30 C · m Un sistema costituito da due cariche +e e -e a d = 1 Å ha M: 1 ,6 0 1 0 -1 9 C 1 0 -1 0 m M 4 ,8 D -30 3 ,3 4 1 0 C m/D - - + - - •Se una delle due fosse la struttura effettiva dell’ozono, gli angoli di legame non sarebbero uguali. In questo caso si introduce il concetto di RISONANZA per conciliare le osservazioni sperimentali con due o più strutture di Lewis •Si ritiene che ciascuna delle strutture di Lewis possibili, dette STRUTTURE DI RISONANZA, contribuisca alla struttura effettiva che non si è in grado di scrivere •La struttura effettiva dell’ozono non corrisponde effettivamente a nessuna delle due strutture scritte, bensì ad una struttura intermedia detta IBRIDO DI RISONANZA, in cui la linea a puntini rappresenta gli elettroni delocalizzati. O. . O. . .O I legami covalenti polari vengono descritti come ibridi di risonanza tra un legame covalente puro ed un legame ionico Esempio: H-F H–F I H+ F - formule limite II L’energia di risonanza è la differenza tra il valore più basso delle energie delle formule limite e l’energia effettiva della molecola EI < EII l’energia della molecola reale E < EI Energia di risonanza = EI – E Il legame ha circa il 43% di carattere ionico E’ INDISPENSABILE RICORDARE CHE: 1. Le strutture di Lewis che contribuiscono all’ibrido di risonanza differiscono solo per le posizioni assegnate alle coppie di elettroni, in nessun caso differiscono per le posizioni assegnate agli atomi; 2. Le strutture di Lewis che contribuiscono alla risonanza differiscono per il numero di coppie di elettroni di legame tra coppie di atomi; 3. L’ibrido si risonanza rappresenta un’unica struttura intermedia e non diverse strutture che si interconvertono continuamente. I COMPOSTI DI COORDINAZIONE Gli elementi di transizione sono caratterizzati dal parziale riempimento degli orbitali d di uno strato n e dal riempimento, spesso completo, dell’orbitale s dello strato successivo n+1. Nella formazione di ioni positivi, gli elettroni che vengono persi per primi da questi elementi sono gli (n+1)s. Nella formazione di legami covalenti, questi ioni hanno a disposizione sia gli orbitali dello strato n+1, cioè orbitali s, p, e d, che degli orbitali nd. Un atomo o uno ione che si lega ad un metallo di transizione mette a disposizione un orbitale e due elettroni per realizzare un legame covalente. Es. [M(NH3)6] 2+ I legami M-N sono covalenti e i due elettroni sono forniti dall’azoto dell’ammoniaca. Tali legami sono spesso polari con polarità diretta verso l’atomo che mette in compartecipazione la coppia elettronica. Quest’atomo si chiama DONATORE e la molecola o ione a cui appartiene l’atomo donatore si chiama LEGANTE. Il numero di legami che un metallo di transizione può formare è limitato dalla repulsione sterica tra gli atomi che gli si dispongono intorno, più che dal numero di orbitali vuoti a disposizione. Il numero di atomi donatori a cui e’ legato l’atomo centrale in un composto di coordinazione si chiama numero di coordinazione. I COMPOSTI DI COORDINAZIONE La maggior parte della chimica dei metalli di transizione si basa sulla loro capacità di formare legami covalenti coordinati. Il risultato della formazione di tali legami è di norma uno IONE COMPLESSO, ovvero uno ione costituito da diverse molecole o ioni, legati ad uno ione o ad un atomo metallico mediante legami covalenti coordinati. Le molecole o gli ioni legati allo ione metallico centrale sono detti LEGANTI. Ciascun legante (in questo caso una molecola d’acqua, possiede uno o più atomi con coppie solitarie e questi atomi si legano all’atomo o allo ione metallico centrale mediante legami covalenti coordinati. La carica di uno ione complesso è determinata dalla carica dello ione metallico o dalle eventuali cariche negative degli ioni legati ad esso. Teoria del legame di valenza TEORIA DEL LEGAME DI VALENZA La teoria del legame di valenza costituisce l’interpretazione quantomeccanica della teoria di Lewis. Nell'approccio di Lewis il legame covalente è dovuto alla condivisione di una coppia di elettroni da parte di due atomi. Anche la teoria del legame di valenza (VB) è strettamente collegata al concetto di accoppiamento elettronico, con ogni coppia di elettroni che lega appunto due nuclei. Secondo la teoria VB un legame tra due atomi si forma se sono verificate le seguenti condizioni: 1. Un orbitale di un atomo ed un orbitale dell’altro atomo si sovrappongono 2. Il numero complessivo di elettroni contenuti nei due orbitali sovrapposti non è maggiore di due La forza del legame dipende dal grado di sovrapposizione, maggiore è la sovrapposizione e più forte è il legame 1s1 H • Cl [Ne] 3s2 3p5 • z Classificazione dei legami Orbitali s - s • 1s H + • • 1s H 1s • 1s H2 Simmetria cilindrica attorno all’asse internucleare Orbitali s - p H Cl [Ne] 3s2 3p5 1s1 • + 1s • 3pz • • HCl Simmetria cilindrica attorno all’asse internucleare Orbitali p - p Ci sono due modi in cui gli orbitali p si possono sovrapporre (es. F2 ) F [He] 3s2 3p5 • 2pz + • 2pz • • F2 Simmetria cilindrica attorno all’asse internucleare Quando si ha simmetria cilindrica attorno all’asse internucleare il legame è di tipo . Gli orbitali si sovrappongono “frontalmente” Orbitali p - p C’è un’altra maniera in cui gli orbitali p si possono sovrapporre Non c’è simmetria cilindrica attorno all’asse internucleare. Gli orbitali si sovrappongono “lateralmente”. C’è un piano di densità elettronica nulla per l’asse internucleare. Legame di tipo Esempio : Molecola N2 ogni atomo N ha configurazione elettronica 1s2 2s2 2p3 si formano un legame di tipo e due legami di tipo Legame triplo x LEGAMI σ E π La sovrapposizione di orbitali atomici di tipo s (s + s) e di orbitali atomici di tipo s e p (s + p, o p + p disposti in modo colineare) porta alla formazione di legami σ. L’orbitale s di un atomo può sovrapporsi con l’orbitale p di un altro atomo per formare un legame σ solo se l’orbitale p è orientato lungo l’asse internucleare. I legami π originano dalla sovrapposizione di orbitali p paralleli tra di loro e perpendicolari all’asse internucleare. Legami sigma e pi-greco legame covalente parziale sovrapposizione di 2 orbitali legame direzionale lungo la congiungente dei 2 nuclei 2 orbitali paralleli legame legame sovrapposizione 2 orbitali p parziale sovrapposizione 2 orbitali p paralleli sovrapposizione di 2 orbitali ibridi sp3 formazione legame sovrapposizione 4 ibridi sp2 →1 legame → 1 legame La geometria delle molecole In pratica: 1. Si determinano gli elettroni di valenza presenti nella molecola sommando gli elettroni di valenza degli atomi che si legano 2. Si determina quindi il numero di coppie di elettroni totali da sistemare nella molecola 3. Si individua l’atomo centrale che generalmente è l’atomo meno elettronegativo (il primo a sinistra nella formula, eccetto per H2O) 4. Si legano gli altri atomi all’atomo centrale ognuno con un singolo legame 5. Si dispongono tre doppietti intorno ad ogni atomo periferico (eccetto per l’H) in modo che questi raggiungano la configurazione otteziale 6. Si dispongono le restanti coppie di elettroni (di non legame), se vi sono, intorno all’atomo centrale La geometria della molecola viene determinata sulla base della disposizione che minimizza la repulsione tra le coppie di elettroni (di legame e di non legame) disposte intorno all’atomo centrale AX2 BeCl2, CO2 AX3 BF3, SO3 AX2E SnCl2 AX4 CH4, CCl4 AX3E NH3 NF3 SO32AX2E2 H2O AX5 AX4E AX3E2 AX2E3 AX6 AX5E AX4E2 IBRIDAZIONE Esempio: struttura della molecola del metano CH4 1s 2s 2p Configurazione elettronica del C Per esempio il carbonio può utilizzare la configurazione in cui un elettrone 2s viene eccitato e va ad occupare l'orbitale 2p vuoto E E 2p 2p 2s 1s 2s 1s Tale eccitazione richiede energia che però è più che compensata dall'energia che si guadagna in seguito alla formazione di 2 legami addizionali (4 legami anzichè 2) che il carbonio può ora formare In realtà la semplice eccitazione non riesce a spiegare completamente le proprietà dei quattro legami. Infatti nella configurazione eccitata del carbonio i quattro orbitali spaiati non sono equivalenti (un 2s e tre 2p) e i quattro legami deriverebbero dalla sovrapposizione degli orbitali 1s di tre idrogeni con i tre orbitali 2px , 2py e 2pz del carbonio e dell’orbitale 1s del restante idrogeno con l’orbitale 2s del carbonio: y H • z • y C x • H • C z • H x •H Tre angoli HCH di 90° Il restante qualsiasi Queste previsioni sono però in contrasto con i dati sperimentali secondo cui i quattro legami C-H del CH4 sono equivalenti. Il metano ha infatti una geometria tetraedrica con i quattro legami C-H tutti della stessa lunghezza e gli angoli HCH tutti uguali e pari a 109.5° Nella teoria VB si assume che i quattro orbitali di valenza del carbonio si combinino fra di loro per dare quattro nuovi orbitali equivalenti e isoenergetici detti orbitali ibridi. In generale un orbitale ibrido è una combinazione lineare di orbitali atomici di uno stesso atomo. Dal punto di vista della meccanica quantistica si ha: sp3 = c12s+ c22px + c3 2py+ c42pz Nel caso del carbonio in CH4 si ottengono quattro orbitali ibridi, chiamati sp3 perchè derivano dalla combinazione di un orbitale s e tre orbitali p. I quattro orbitali ibridi sono isoenergetici e vanno riempiti in accordo con la regola di Hund: E sp3 1s Calcoli teorici mostrano che i quattro orbitali ibridi sono bilobati ma con un lobo molto maggiore dell'altro e sono diretti dal centro verso i quattro vertici del tetraedro. Combinazione lineare Sullo stesso sistema cartesiano Secondo la teoria VB i quattro legami C-H si formano in seguito alla sovrapposizione di ciascuno dei quattro orbitali ibridi sp3 dell'atomo di carbonio con l'orbitale 1s di un atomo di idrogeno. L’ibridazione degli orbitali del carbonio e la formazione dei legami C-H possono essere schematizzati come segue: Atomo C config. fondamentale Atomo C config. eccitata Atomo C ibridizzato 1s 2s 2p 1s 2s 2p 1s sp3 La sovrapposizione con i 4 orbitali 1s dell’idrogeno ognuno con un elettrone permette al carbonio di rispettare la regola dell’ottetto Atomo C in CH4 1s sp3 elettroni dell’idrogeno Orbitali ibridi Il carbonio nei suoi composti -escluso CO (monossido di carbonio) – ha 4 elettroni, ma solo 2 spaiati, nel livello più esterno Gli orbitali ibridi si ottengono per combinazione lineare di orbitali atomici Il n. di orbitali ibridi è uguale al n. di orbitali atomici che si combinano C: 2s2 2p2 2sp3 gli orbitali ibridi sono degeneri C ha 4 elettroni di valenza spaiati 4 legami Si possono ottenere tipi diversi di orbitali ibridi combinando linearmente tipi diversi (e/o in numero diverso) di orbitali atomici. Il numero di orbitali ibridi ottenuti è uguale al numero totale di orbitali atomici combinati e il simbolo per indicarli usa il numero dei vari orbitali combinati. Ad esempio gli orbitali ibridi sp3 si chiamano così perchè derivano dalla combinazione di un orbitale s e tre orbitali p e sono quattro perchè in tutto si combinano 4 orbitali. L’orbitale s può anche combinarsi con solo due o un orbitale p per dare orbitali ibridi di tipo: 1 orbitale s + 2 orbitali p 3 orbitali ibridi sp2 1 orbitale s + 1 orbitale p 2 orbitali ibridi sp Orbitali ibridi sp2 Consideriamo la molecola BF3 Il boro ha configurazione elettronica fondamentale 1s22s22p1 con un solo elettrone spaiato e la formazione di tre legami covalenti con il fluoro in BF3 e la sua geometria trigonale planare vengono spiegate nella teoria VB con uno schema di ibridizzazione simile a quello visto per il carbonio. Atomo B config. fondamentale Atomo B config. eccitata Atomo B ibridizzato 1s 2s 2p 1s 2s 2p 1s sp2 Un orbitale 2s e due orbitali 2p = tre orbitali ibridi sp2 2pz sp2 = c12s+ c22px + c3 2py I tre legami B-F si formano per sovrapposizione dei tre orbitali ibridi sp2 del boro con ciascuno degli orbitali spaiati del fluoro F 1s 2s 2p Si noti che il boro conserva un orbitale 2p non ibrido, vuoto, perpendicolare al piano della molecola che ne determina importanti proprietà chimiche. Esso può formare ad esempio un legame con una molecola che possiede una coppia solitaria. Orbitali ibridi sp Consideriamo la molecola BeF2. Il berillio ha configurazione elettronica fondamentale 1s22s2 senza alcun elettrone spaiato e la formazione di due legami covalenti con il fluoro in BeF2 e la geometria lineare vengono spiegate nella teoria VB con il seguente schema di ibridizzazione: Atomo Be config. fondamentale Atomo Be config. eccitata Atomo Be ibridizzato 1s 2s 2p 1s 2s 2p 1s sp 2p Un orbitale 2s e un orbitale 2p = due orbitali ibridi sp sp = c12s+ c22px I due legami Be-F si formano per sovrapposizione dei due orbitali ibridi sp del boro con ciascuno degli orbitali contenenti un elettrone del fluoro F 2s 1s F 2p 2p Be Due ibridi sp su Be F 2p Si noti che il berillio conserva due orbitali 2p vuoti non ibridizzati L'ibridazione è un modello, cioè non è un fenomeno fisico reale, ma una procedura matematica per ottenere funzioni d'onda, gli orbitali ibridi appunto, che spiegano la nuova conformazione e le proprietà della molecola (legami equivalenti in determinate direzioni dello spazio). Questi orbitali semplificano la descrizione della molecola L’ibridazione viene introdotta per spiegare una geometria molecolare diversa da quella che ci si aspetterebbe con l’uso degli orbitali atomici puri Molecola di H2O Anche se l'ossigeno ha due elettroni spaiati è necessario ricorrere allo schema di ibridizzazione sp3 per giustificare la sua geometria, piegata con angolo HOH=105° Atomo O config. fondamentale Atomo O ibridizzato Formazione dei 2 legami O-H secondo la teoria VB per sovrapposizione dei due sp3 semiriempiti con gli 1s dei due idrogeni. Le due coppie solitarie occupano i due restanti orbitali sp3 1s 1s 2p 2s sp3 H h h h Si noti che dei quattro orbitali sp3 due sono doppiamente occupati e costituiscono le coppie solitarie mentre due sono semiriempiti e formano i due legami O-H per sovrapposizione con gli orbitali 1s dei due atomi di idrogeno. Se non si facesse uso degli ibridi sp3 i legami i legami O-H sarebbero formati dalla sovrapposizione di due orbitali 2p con gli 1s degli H e l'angolo HOH dovrebbe essere di 90° (cioè quello tra due orbitali p) in disaccordo col valore sperimentale Molecola di NH3 Anche in questo caso l'azoto ha già tre elettroni spaiati ma è necessario ricorrere allo schema di ibridizzazione sp3 per giustificare la sua geometria, piegata con angolo HNH=107° Atomo N config. fondamentale Atomo N ibridizzato Formazione dei 3 legami N-H secondo la teoria VB per sovrapposizione dei tre sp3 semiriempiti con gli 1s dei tre idrogeni La coppia solitaria occupa il restante orbitale sp3 1s 1s 2p 2s sp3 Uno dei quattro orbitali sp3 è occupato dalla coppia solitaria mentre tre sono occupati da un elettrone spaiato e formano i legami N-H per sovrapposizione con gli orbitali 1s degli atomi di idrogeno. Anche qui se non si facesse uso degli ibridi sp3 i legami i legami NH sarebbero formati dalla sovrapposizione di due orbitali 2p con gli 1s degli H e l'angolo HNH dovrebbe essere di 90° in disaccordo con il valore sperimentale. Teoria VB per 5 e 6 coppie di elettroni In questo caso è necessario ricorrere agli ibridi sp3d e sp3d2 Molecola PF5 Per formare 5 legami l’atomo di fosforo deve utilizzare gli orbitali ibridi sp3d in accordo con la geometria bipiramidale E E E 3d 3d 3p 3s Atomo P configuraz. fondamentale 3p 3d sp3d 3s Atomo P configuraz. eccitata Atomo P ibridizzato Come visto per gli orbitali spx questo processo è schematizzato su un’unica linea come segue: Atomo P config. fondamentale Atomo P config. eccitata 3s 3p 3d 3s 3p 3d Atomo P ibridizzato sp3d 3d Essendo ottenuti dalla combinazione lineare di cinque orbitali, un s, tre p, e un d, gli orbitali ibridi sp3d sono cinque Gli orbitali ibridi sp3d hanno la solita forma bilobata con uno dei due lobi molto piccolo. Essi sono disposti attorno all’atomo di fosforo nelle direzioni dei vertici di una bipiramide trigonale che è poi la geometria molecolare I cinque legami P-F sono formati dalla sovrapposizione di ciascuno dei cinque orbitali sp3d semiriempiti con un orbitale 2p del fluoro Molecola SF6 Per formare i 6 legami l’atomo di zolfo deve utilizzare orbitali ibridi sp3d2 in accordo con una geometra ottaedrica E E E 3d 3d 3p 3d 3p sp3d2 3s Atomo S configuraz. fondamentale 3s Atomo S configuraz. eccitata Atomo S ibridizzato Questo processo è schematizzato su un’unica linea come: Atomo S config. fondamentale Atomo S config. eccitata 3s 3p 3d 3s 3p 3d Atomo S ibridizzato sp3d2 3d Essendo ottenuti dalla combinazione lineare di sei orbitali, un s, tre p, e due d, gli orbitali ibridi sp3d2 sono sei Gli orbitali ibridi sp3d2 hanno la solita forma bilobata con uno dei due lobi molto piccolo e spesso non disegnato. Essi sono disposti attorno all’atomo di zolfo nelle direzioni dei vertici di un ottaedro che è la geometria molecolare I sei legami S-F sono formati dalla sovrapposizione di ciascuno dei sei orbitali sp3d2 semiriempiti con un orbitale 2p del fluoro Orbitali ibridi e teoria VSEPR Esiste una corrispondenza diretta tra lo schema di ibridizzazione dell'atomo centrale e la teoria VSEPR. In particolare per ognuna delle geometrie previste dalla teoria VSEPR esiste uno schema di ibridizzazione tale che gli orbitali ibridi corrispondenti sono disposti nello spazio con la stessa geometria e, in seguito alla sovrapposizione con un orbitale degli atomi esterni, conducono esattamente alla stessa geometria molecolare. Orbitale ibrido n° orbitali geometria VSEPR n° coppie ________________________________________________ sp 2 lineare 2 sp2 3 trigonale planare 3 sp3 4 tetraedrica 4 sp3d 5 trigonale bipiramidale 5 sp3d2 6 ottaedrica 6 Nel caso in cui ci siano coppie non leganti queste occupano alcuni degli orbitali ibridi e solo gli orbitali ibridi con l’elettrone spaiato formano un legame per sovrapposizione con l’orbitale semiriempito dell’atomo esterno. Ad esempio le seguenti molecole hanno tutte la stessa disposizione tetraedrica dei quattro ibridi sp3, ma geometrie molecolari diverse D d CH4 sp3 tetraedrica NH3 sp3 trigonale piramidale H 2O sp3 piegata Architettura delle molecole e forza dei legami Nella formazione di legami gli orbitali ibridi permettono la massima distanza tra le coppie di elettroni (geometrie molecolari) e la maggior sovrapposizione (legami più forti) orbitali ibridi 1s+3p 4 ibridi sp3 1s+2p 3 ibridi sp2 1 s +1 p 2 ibridi sp Distanze angolari tra gli orbitali ibridi tetraedro planari Carica formale La coppia di elettroni che costituisce un legame è in compartecipazione tra i due atomi legati. Immaginiamo di spezzare tutti i legami nella molecola attribuendo per ogni legame un elettrone ad ogni atomo legato: O Cl Cl carica formale: Cl = 0, O = 0 La carica che l’atomo viene ad assumere è detta carica formale, essa è la differenza tra il numero di elettroni dell’atomo neutro ed il numero di elettroni della particella così formata Quando per una molecola è possibile scrivere più di una formula di struttura elettronica, la formula più probabile è quella in cui gli atomi hanno carica formale più bassa o uguale a 0. Esempio: POCl3, BeCl2 Risonanza Esempio: struttura della molecola SO3 (ordine di legame=1.33) , C6H6 (ordine di legame=1.5) Quando la struttura elettronica di un molecola reale viene descritta come una combinazione di n formule limite, si dice che si ha “risonanza” tra le n formule limite e che la struttura elettronica della molecola reale è un ibrido di risonanza delle forme limite L’energia di risonanza è la differenza tra il valore più basso delle energie delle formule limite e l’energia effettiva della molecola se EI < EII l’energia della molecola reale E < EI e l’energia di risonanza = EI – E Esercizio. scrivere le formule risonanti per le seguenti molecole o ioni molecolari: NO2, NO3-, SO32-
Scaricare