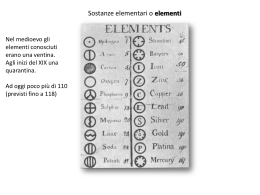
Configurazioni elettroniche degli elementi: descrizione esatta della disposizione degli elettroni negli orbitali dell’atomo (Aufbau) 1. Il riempimento degli orbitali da parte degli elettroni avviene seguendo la scala di En. crescente 2. Ogni orbitale NON puo’ essere occupato da piu’ di due elettroni con spin antiparallelo ANCHE In un atomo ogni elettrone non puo’ avere i 4 numeri quantici uguali! (Principio di esclusione di Pauli) 3. Gli elettroni tendono ad occupare il numero massimo di orbitali dello stesso tipo (stessa Energia!) (Regola di Hund) SISTEMA PERIODICO O TAVOLA PERIODICA Costruzione ideale degli atomi di tutti gli elementi partendo dall’H e procedendo per numero atomico crescente, aggiungendo un protone al nucleo e, di conseguenza, un e- nell’orbitale a più bassa En disponibile (regola di Hund) 1. Scrivere sulla stessa fila orizzontale (riga) i simboli degli elementi costruiti progressivamente fino a quando la freccia dello schema a frecce non rinvia all’orbitale s del livello successivo. 2. Passare su una nuova riga quando si inizia il riempimento dell’orbitale s anche se il livello precedente non è stato completato Ciascun elemento della stessa riga (PERIODO) si differenzia dal precedente per un e- in più sull’ultimo livello, e dal successivo per un e- in meno Tutti gli elementi di una stessa colonna verticale (GRUPPO) presentano la stessa configurazione elettronica sull’ultimo livello, e hanno lo stesso numero di e- di valenza IMPORTANTE!!! Le proprietà chimiche e fisiche di un elemento dipendono dalla sua configurazione elettronica più esterna (e- di valenza) Tali proprietà sono MOLTO simili per elementi dello stesso gruppo e variano gradualmente da un elemento al successivo di un periodo PRIMO PERIODO Contiene solo due elementi, l’Idrogeno (H) e l’Elio (He) - Idrogeno Z = 1 configurazione elettronica 1 s1 - Elio Z = 2 configurazione elettronica 1 s2 (riempimento dell’orbitale 1s) SECONDO PERIODO TERZO PERIODO QUARTO PERIODO QUINTO PERIODO SESTO PERIODO SETTIMO PERIODO PROPRIETA’ PERIODICHE Raggio atomico Energia di Ionizzazione Energia necessaria per allontanare a distanza infinita un e- da un atomo (allo stato gassoso) isolato trasformandolo in uno ione positivo (CATIONE) A (g) A+(g) + e- AUMENTA lungo un PERIODO Aumenta la carica nucleare al crescere del n° atomico, diminuiscono le dimensioni atomiche, gli e- sono maggiormente attratti dalla carica (+) del nucleo INVERSIONI E.I. (B)< E.I. (Be) B (III Gruppo) 1s22s22p1 Be (II Gruppo) 1s2 2s2 Completezza guscio 2: maggiore stabilità E.I. (O)< E.I. (N) O (VI Gruppo) 1s22s22p4 N (V Gruppo) 1s2 2s2 2p3 Semicompletezza guscio 2: maggiore stabilità Energia di Ionizzazione DIMINUISCE lungo un GRUPPO Aumento di n (n° quantico principale) Aumentano le dimensioni atomiche e quindi la distanza dell’edal nucleo Diminuisce l’attrazione dell’e- verso il nucleo (+) Affinità Elettronica Energia che viene rilasciata da un atomo (allo stato gassoso) nell’acquistare un e- trasformandolo in uno ione negativo (ANIONE) A(g) + e- A- (g) AUMENTA lungo un PERIODO DIMINUISCE lungo un GRUPPO Più piccolo è l’atomo e più forte è la tendenza ad accettare un e- Elettronegatività Tendenza che ha l’atomo, nella molecola, ad attrarre a sé gli e- di legame E = E.I. A.E. 2 AUMENTA lungo un PERIODO DIMINUISCE lungo un GRUPPO
Scaricare