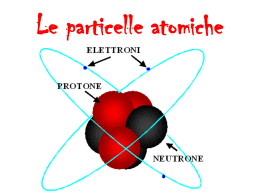
MODELLI ATOMICI Gli atomi sono i piccoli mattoni che compongono la materia. Circa 2500 anni fa, il filosofo DEMOCRITO credeva che tutta la materia fosse costituita da piccole particelle che chiamò atomi. Democrito sosteneva che dovevano esistere differenti tipi di atomi, ciascuno con specifiche proprietà. Il filosofo ARISTOTELE, al contrario, riteneva che la materia fosse formata da una combinazione di quattro elementi: acqua, aria, fuoco e terra. La teoria di Aristotele è stata accettata per molti secoli, ma a partire del XIX secolo, grazie a numerosi esperimenti, gli scienziati hanno dimostrato la esistenza degli atomi. Nell’anno 1809 DALTON formulò il primo modello atomico e segnò l’inizio della chimica come scienza. Nel modello atomico di Dalton ciascun tipo di atomo è rappresentato da una piccola sfera piena di massa e un tipo di atomi è differente da un altro tipo di atomo quando ha diversa massa. Modello Atomico di Dalton Sfera piena di massa Nel 1879 THOMSON, studiando il fenomeno dell’elettricità, dimostrò che la corrente elettrica era generata da un flusso di particelle con carica negativa che chiamò elettroni. Poiché tali particelle provenivano dalla materia e la materia era formata da atomi, gli elettroni dovevano provenire dall’interno degli atomi. (La carica elettrica è una proprietà che hanno alcuni materiali di attrarre o respingere altri materiali. Esistono due tipi di cariche elettriche: positiva e negativa. È stato dimostrato che le cariche dello stesso segno si respingono mentre le cariche di segno opposto si attraggono) Considerato che gli atomi sono neutri, Thomson formulò un modello atomico secondo il quale l’atomo era una sfera piena di massa con carica positiva all’interno della quale erano distribuiti omogeneamente tanti elettroni da neutralizzare la carica positiva. Modello atomico di Thomson Elettroni (particelle con carica negativa) Sfera piena di massa con carica positiva Nel 1899 RUTHERFORD scoprì che un materiale, chiamato uranio, emetteva spontaneamente particelle veloci con carica positiva che chiamò particelle α (alfa). Nel 1909 RUTHERFORD E MARSDEN, studiando cosa accadesse quando le particelle alfa attraversavano un sottile foglio d’oro, dimostrarono un nuovo modello atomico secondo il quale: • La carica positiva di un atomo non è distribuita uniformemente nell’atomo, ma è concentrata in una regione centrale molto piccola che chiamò nucleo. • Gli elettroni, di carica negativa, ruotano nello spazio attorno il nucleo. Nel 1920 RUTHERFORD poteva dimostrare che l’atomo era formato da tre particelle subatomiche fondamentali: 1. I protoni: sono particelle subatomiche con carica positiva unitaria pari a +1 e hanno una massa di1,674𝑥10−24 g (grammi) 2. I neutroni: sono particelle subatomiche prive di carica elettrica che si trovano nel nucleo. Hanno una massa quasi uguale a quella dei protoni:1,675𝑥10−24 g. 3. Gli elettroni: sono particelle subatomiche con carica negativa unitaria -1 e ruotano nello spazio attorno il nucleo. La massa di ogni elettrone è di9,11𝑥10−29g (circa 2000 volte più piccola di quella del protone) per cui risulta trascurabile rispetto alla massa del protone e del neutrone. Atomo di Rutherford Sfera vuota Elettroni (negativi) Nucleo formato da protoni positivi e neutroni (contiene la massa dell’atomo) Nel 1913 il fisico danese BOHR aveva osservato che quando gli atomi di idrogeno sono riscaldati emettono radiazioni luminose. Da queste osservazioni Bohr propone un nuovo modello atomico dove gli elettroni si muovono con velocità costante intorno al nucleo occupando orbite circolari ben definite, ciascuna a una diversa distanza dal nucleo e caratterizzate da precisi valori dell'energia. Le energie che un elettrone può assumere sono chiamate livelli energetici Atomo di Bohr Livelli energetici (orbite) Nucleo Elettroni nnnnnnm n=3 n=1 n=2 L'energia delle orbite aumenta all'aumentare della distanza dal nucleo. L'orbita più vicina al nucleo è definita con n = 1 e possiede l'energia E1 ; l'orbita successiva n = 2 con energia E2 e così via. Un elettrone non può esistere tra due livelli energetici, ma può occupare solo un ben determinato livello energetico. Quando un elettrone assorbe energia (ad esempio, riscaldando l'atomo) passa da un livello di minor energia (stato fondamentale) a un livello di maggior energia (stato eccitato) , quando l'elettrone ritorna al livello energetico inferiore, emette una quantità di energia luminosa uguale alla differenza di energia tra il livello di maggior energia e quello di minore energia. Gran parte di quanto oggi si sa sul comportamento degli elettroni proviene dall'analisi della luce emessa o assorbita dalle sostanze chimiche. Nell'anno 1927, Heinsenberg dimostrò che è impossibile misurare con precisione e contemporaneamente due grandezze fisiche relative allo stesso evento. Per definire esattamente l'orbita che l'elettrone compie intorno al nucleo si deve misurare contemporaneamente la velocità e la posizione dell'elettrone, e ciò è impossibile. Con il progresso fatto dalle altre scienze, si può calcolare, matematicamente, la probabilità di trovare l'elettrone in uno spazio intorno al nucleo. Si definisce orbitale atomico la regione dello spazio intorno al nucleo dove è massima la probabilità di trovare l'elettrone. Quindi, il concetto di orbita fu sostituito con il concetto di orbitali atomici. Alla luce di queste affermazioni si propone l'attuale modello atomico quantomeccanico, nel quale, gli elettroni si trovano negli orbitali. Gli orbitali atomici differiscono per dimensione, forma e orientamento nello spazio e vengono definiti da tre parametri chiamati numeri quantici. 1. NUMERO QUANTICO PRINCIPALE, si rappresenta con la lettera n e definisce l'energia e la distanza dal nucleo, quindi, definisce il livello energetico nel quale si trova l'orbitale. Può assumere tutti i valori interi da 1 a 7 n = 1; n= 2; n= 3 e così via. L'energia e le dimensioni degli orbitali aumentano all'aumentare della distanza dal nucleo. E1 < E2 < E3 < E4 ecc. Livelli energetici Nucleo E₂ E₁ n=1 E₃ n=2 n=3 2. NUMERO QUANTICO SECONDARIO, si indica con la lettera l: definisce la forma dell'orbitale assume tutti i valori interi da 0 a n-1. Quando l = 0, l'orbitale è sferico e si rappresenta con la lettera s quando l = 1, l'orbitale ha forma lobata (di 8) e si rappresenta con la lettera p Quando l = 2, l'orbitale ha forma complessa e si rappresenta con la lettera d Quando l = 3, l'orbitale ha forma molto complessa e si indica con la lettera f. 3. NUMERO QUANTICO MAGNETICO, si indica con la lettera m: definisce l'orientamento dell'orbitale nello spazio. Può assumere tutti i valori interi che vanno da -l a +l zero compresso. Per determinare l'orientamento nello spazio, utilizziamo il sistema di assi cartesiani x, y e z, posizionando il nucleo dell'atomo dove si incrociano i tre assi. i tre assi cartessiani x,y e z. Nucleo dell’atomo y x z Utilizzando i tre parametri: n, l e m, si può costruire la struttura dell’atomo, ossia determinare l’insiema degli orbitali possibili nei quali possono essere contenuti gli elettroni. Nel primo livello energetico n=1 l=0 m=0 per cui contiene un orbitale rappresentato con il simbolo 1s Orbitale 1s Nel secondo livello energetico n=2 l = 0 (s) l =1(p) m=0 m = -1, 0, +1 per cui ncontiene 4 orbitali: uno s e 3 p. I tre orbitali p sono isoenergetici (contengono la stessa quantità di energia) e si rappresentanop con i simboli: 2s 2p y 2p 2p 2p 1s z 2s x Nel terzo livello energetico n=3 l = 0 (s) l =1(p) l =2(d) m=0 m = -1, 0, +1 m = -2,-1,0,+1,+2 per cui contiene 9 orbitali: uno di tipo s, tre di tipo p isoenergeticie cinque di tipo d isoenergetici e si rappresentano con i simboli: 1s 2s 2p Nel terzo livello energetico n=4 l = 0 (s) l =1(p) l =2(d) l =3 m=0 m = -1, 0, +1 m = -2,-1,0,+1,+2 m = -3,-2,-1,0,+1,+2,+3 contiene 16 orbitali: uno di tipo s, tre di tipo p, cinque di tipo d e sette di tipo f isoenergetici e si rappresentano con i simboli: 1s 2s 2p 3s 3p Risolvendo per i sette livelli energetici troviamo la seguente struttura atomica 1s 2s 2p 3s 3p 3d
Scaricare