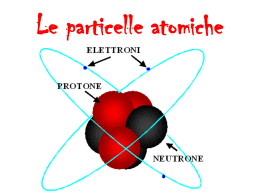
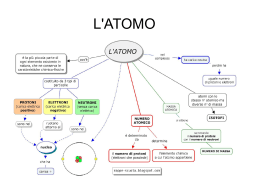
MATERIA Tutto ciò che occupa spazio ed ha una sua massa Materia vivente Organismi viventi dotati di un ciclo vitale Materia non vivente Oggetti che non hanno mai vissuto Materia Sostanze Composti Formati da atomi di natura diversi Elementi Formati da atomi tutti uguali ELEMENTI COMPOSTI MOLECOLE la più piccola particella che conserva le caratteristiche chimiche di ogni elemento ATOMI Ricorda che atomi e molecole sono impossibili da osservare ad occhio nudo anche con i più potenti microscopi….ciò nonostante puoi rilevare la loro esistenza osservando fenomeni fisici e chimici Ma com’e fatto un atomo? Prima un po’ di storia….atomica!!!! I filosofi greci (Leucippo, Epicuro, Democrito), già nel V secolo a.C ipotizzarono la sua presenza. Il nome atomo deriva infatti dal greco àtomos -, indivisibile. Già nel XVII secolo si cominciò a sospettare che l’ atomo fosse costituito da particelle più piccole dotate di carica elettrica Queste particelle molto piccole e leggere furono chiamate elettroni se avevano carica negativa, protoni se avevano carica positiva. Elettroni e protoni si attirano perché hanno carica di segno opposto: questo è il motivo per cui nell’ atomo queste particelle stanno riunite insieme. Ma come erano disposte queste particelle al’ interno di un atomo? Modello atomico di Thomson (1898) Il fisico inglese Joseph Thomson immaginò che un atomo fosse costituito da una sfera di materia caricata positivamente in cui gli elettroni - negativi - erano immersi. (modello a panettone). Per le sue scoperte Thomson ricevette il premio Nobel nel 1906 Elettrone = uvetta Pasta = materia positiva Modello di Rutherford (1911) Rutherford dopo un famoso esperimento di fisica dedusse che l’ atomo era costituito da spazi vuoti e spazi pieni dove si trovavano le particelle subatomiche (elettrone e protone). Al centro dell’ atomo era concentrata la carica positiva (protone): questa zona è detta nucleo, mentre in periferia si trovava l’ elettrone che ruotava intorno al nucleo. Il tutto come un piccolo sistema solare dove gli elettroni sono i pianeti che ruotano intorno al Sole (Modello a planeterio) Per le sue scoperte Rutherford ricevette il premio Nobel nel 1908 Nucleo Elettroni Ma nel nucleo ci sono solo protoni? Nel 1930 all’ interno del nucleo di alcuni atomi furono scoperte delle particelle prive di carica elettrica che furono chiamate neutroni a questi risultati si giunse grazie alle ricerche di diversi fisici tra cui Bothe, Irene Curie e Friederic Joliot (vincitori del premio Nobel per la chimica nel 1935) Protoni Neutroni Gli isotopi In ogni atomo di un dato elemento c’è sempre un ugual numero di protoni ed elettroni (perché la carica deve essere nulla) E’ possibile però che ci siano atomi con un numero diverso di neutroni Questi atomi prendono il nome di ISOTOPI L’ atomo di idrogeno per esempio è presente sotto tre forme: Idrogeno propriamente detto che ha un solo protone nel nucleo ed un solo elettrone all’ esterno, il Deuterio che ha un protone ed un neutrone nel nucleo ed un elettrone all’ esterno, il Trizio che ha un protone ed due neutroni nel nucleo ed un elettrone all’ esterno. Idrogeno Deuterio Trizio Neutroni
Scaricare