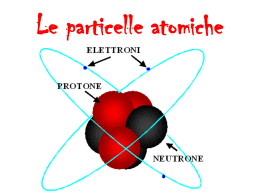
L’ EVOLUZIONE DEI MODELLI ATOMICI NEL TEMPO A cura di: Valentina Calavitta e Vito Leone Classe III E DEFINIZIONE DI ATOMO L'atomo è la più piccola parte di ogni elemento esistente in natura che ne conserva le caratteristiche chimiche Un atomo era inizialmente considerato un'unità indivisibile; la parola deriva dal greco ατομος («atomos»), «che non si può dividere». I primi filosofi che formarono la dottrina dell’ indivisibilità dell’ atomo furono Leucippo, Democrito e Epicuro. LEUCIPPO supponeva che la sostanza degli atomi fosse piena e solida, la chiamò essere e disse che si muove nel vuoto, al quale dette il nome di non essere, dicendo che esso esiste non meno dell'essere." Gli atomi sono indivisibili e inalterabili essendo solidi non contengono vuoto … nel vuoto infinito sono separati fra di loro e si differenziano per forma, grandezza, ordine e disposizione, si muovono nel vuoto e, scontrandosi, in parte rimbalzano e vengono spinti a caso, in parte si collegano … e restano uniti e così avviene la generazione …" INDIETRO Leucippo Mileto nel V secolo a. C. EPICURO Egli utilizza la teoria degli atomi per liberare l'uomo da alcune delle sue paure primordiali, come quella della morte. Grazie alle impronte che le cose sensibili lasciano nell'anima l'uomo è in grado di formulare dei pregiudizi che però non sempre corrispondono alla verità. Epicuro (Samo, 341 AC - Atene, 270/271 AC INDIETRO •1795 Alessandro Volta realizza un dispositivo che produce energia elettrica da una comune reazione chimica. •1860 Crookes effettuò esperienze con il tubo di Geissler inserendo due lamine metalliche. Scoprì che si generava una luce con colori diversi. Constatò la presenza di corpuscoli (raggi catodici) di materia capaci di muovere un mulinello posto sul loro cammino •1895 Thomson lavorò sui raggi catodici e constatò e calcolò il rapporto tra la carica elettrica e la massa. Queste particelle vennero chiamate elettroni. SCOPERTA DELL’ ELETTRONE (fine dell‘ Ottocento) Con la scoperta dell'elettrone fu dimostrato che l'atomo non era affatto indivisibile ma composto da particelle più piccole L’ atomo è composto da un nucleo carico positivamente e da un certo numero di elettroni, carichi negativamente, che gli ruotano attorno. Il numero degli elettroni che ruotano attorno al nucleo è uguale al numero dei protoni nel nucleo. Essendo dette cariche di valore uguale (a parte il segno), un atomo è normalmente elettricamente neutro. Per questo motivo la materia è normalmente elettricamente neutra. STRUTTURA DELL’ ATOMO NUCLEO Parte centrale dell’ atomo NEUTRONE è una particella Subatomica senza carica Elettrica e con massa Di 939,57 MeV/c² PROTONE è una particella Dotata di carica elettrica Che può esistere libera o Legata in un nucleo atomico Il valore della sua carica è Uguale all’ elettrone ma di Segno opposto: 1,602 × 10ˉ19 ELETTRONE È una particella subatomica Possiede una carica elettrica Negativa di Qe = -1,6 x 10 -19 coulomb E di una massa di 9,10 x 10 -31 kg JOHN DALTON Nel 1803 spiegò che le sostanze sono formate dai loro componenti secondo rapporti ben precisi fra numeri interi, ipotizzando che la materia fosse costituita da atomi. Nel 1844 formulò la sua teoria atomica, che enunciava: • la materia è formata da particelle elementari chiamate atomi; • gli atomi di uno stesso elemento sono tutti uguali tra loro; • gli atomi non sono ulteriormente scomponibili; • gli atomi non possono essere né creati né distrutti JOSEPH JOHN THOMSON Nel 1898 Thomson propose il primo modello fisico dell'atomo: aveva scoperto un anno prima l'elettrone. Egli immaginò che un atomo fosse costituito da una sfera di materia caricata positivamene (protoni e neutroni non erano stati ancora scoperti) in cui gli elettroni - negativi - erano immersi. Il modello di Thomson raffigurava l’ atomo come una sfera materiale di raggio r = 10 10 m. La carica positiva e diluita, occupava tutta la sfera, gli elettroni, in numero tale da equilibrare la carica positiva dell’ elemento. Joseph JohnThomson Nobel per la fisica 1906 ESPERIMENTO DI RUTHERFORD Nel 1911 Ernest Rutherford bombardò un sottilissimo foglio di oro, posto fra una sorgente di particelle alfa e uno schermo al solfuro di zinco. Le particelle, passate attraverso la lamina, sarebbero rimaste impresse sullo schermo. L'esperimento portò alla constatazione che i raggi alfa non venivano quasi mai deviati. Essi attraversavano il foglio di oro senza quasi mai esserne disturbati. Solo l'1 % dei raggi incidenti era deviato dal foglio di oro e lo era in modo notevole (alcuni, addirittura, venivano completamente respinti). Solo l'1 % dei raggi incidenti era deviato dal foglio di oro Particelle alfa o raggi alfa Le particelle alfa o raggi alfa sono una forma di radiazione corpuscolare con un basso potere di penetrazione. Consistono di due protoni e due neutroni legati insieme dalla forza forte, I raggi alfa, a causa della loro carica elettrica, interagiscono fortemente con la materia e quindi vengono facilmente assorbiti dai materiali e possono viaggiare solo per pochi centimetri nell'aria. Possono essere assorbiti dagli strati più esterni della pelle umana e così generalmente non sono pericolosi per la vita a meno che la sorgente non venga inalata o ingerita. In questo caso i danni sarebbero invece maggiori di quelli causati da qualsiasi altra radiazione ionizzante. Se il dosaggio fosse abbastanza elevato comparirebbero tutti i sintomi tipici dell'avvelenamento da radiazione. MODELLO PLANETARIO Dai risultati ottenuti, Rutherford propose un modello di atomo in cui quasi tutta la massa dell'atomo è concentrata in una porzione molto piccola, il cosiddetto nucleo (carico positivamente) e gli elettroni gli ruotano attorno così come i pianeti ruotano attorno al sole. PROBLEMI DEL MODELLO DI RUTHERFORD Secondo la teoria elettromagnetica una carica che subisce una accelerazione emette energia sotto forma di RADIAZIONE ELETTROMAGNETICA. Gli elettroni dell'atomo di Rutherford, che si muovono di moto circolare intorno a nucleo, dovrebbero emettere onde elettromagnetiche e quindi, perdendo energia, cadere sul nucleo stesso, cosa che invece non accade. Inoltre un elettrone, nel perdere energia, potrebbe emettere onde elettromagnetiche di qualsiasi lunghezza d'onda. Questa possibilità è stata esclusa nella teoria e nella pratica da studi di Max Planck e, successivamente, di Albert Einstein. SOLUZIONI AL MODELLO DI RUTHERFORD Bohr (1913) propose un modello di atomo basato su tre nuovi postulati da aggiungere al modello planetario di Rutherford 1) Esiste un insieme discreto di orbite stabili, (stati stazionari) per gli elettroni, con energie En, in cui essi non irraggiano. 2) L’atomo irraggia solo nella transizione da uno stato stazionario all’altro, emettendo radiazione di frequenza dipendente dai due stati energetici 3) Il momento angolare dell’ elettrone nelle orbite stabili è quantizzato secondo la regola (orbite circolari) CALAVITTA VALENTINA E LEONE VITO PARTICELLE O RAGGI ALFA Le radiazioni alfa sono nuclei di elio (He), costituite quindi da due protoni e due neutroni. INDIETRO La sua massa è poco più di 1800 volte quella dell'elettrone (circa 1836) e quasi uguale a quella dell’ elettrone. Il protone viene iscritto alla categoria dei barioni, in quanto è "composto" da tre quark, detti di valenza: due up e un down INDIETRO INDIETRO è una particella subatomica senza carica elettrica e con massa di 939,57 MeV/c² (leggermente superiore a quella del protone, pari a 938,27 MeV/c²). I nuclei atomici degli elementi sono composti da protoni e neutroni. Al di fuori del nucleo, i neutroni sono instabili ed hanno una vita di circa 15 minuti. Il neutrone è classificato come barione, e consiste di due quark down e un quark up. La caratteristica dei neutroni, che li differenzia dalle altre particelle subatomiche, è l'assenza di carica elettrica. Questa proprietà dei neutroni ritardò la loro scoperta, li rende molto penetranti, e impossibili da osservare direttamente. INDIETRO L'elettrone viene comunemente rappresentato dal simbolo e-. L'antiparticella dell'elettrone è il positrone, che si differenzia solo per la carica elettrica positiva. La massa dell'elettrone è circa 1/1836 di quella di neutroni e protoni. L'elettrone appartiene alla classe delle particelle subatomiche dette leptoni, che si ritiene siano componenti fondamentali della materia INDIETRO
Scaricare