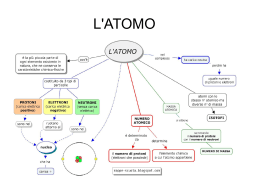
Le particelle atomiche La natura elettrica della materia • Una carica elettrica può essere prodotta per strofinio. • - la carica elettrica è negativa e positiva • - cariche di segno uguale si respingono, cariche di segno opposto si attraggono • - un oggetto elettricamente neutro possiede cariche positive uguali a quelle negative. La struttura deLL’atomo • L’atomo è composto da tre particelle subatomiche: elettrone, protone e neutrone. Le ultime due insieme formano il nucleo mentre l’elettrone gli gira attorno grazie alla forza gravitazionale. La scoperta deLL’eLettrone • La particella in questione fu scoperta da Thomson che riuscì a dimostrare che la radiazione luminosa consisteva di particelle caricate negativamente. Da qui la regola che tutti gli atomi hanno uguali numeri di elettroni e che sono tutti uguali. La scoperta del NUCLEO • Pochi anni dopo Rutherford dimostrò che se si bombardava qualsiasi atomo, gli elettroni venivano deviati come se incontrassero un ostacolo. Così si scoprì il nucleo e che il numero di elettroni bilancia la carica positiva del nucleo. Il numero atomico • Grazie agli esperimenti di Rutherford si dedusse che la carica positiva dei nuclei è sempre un multiplo intero dell’unità positiva. Il numero atomico è diverso per ogni elemento perchè si riferisce ai protoni che un determinato elemento ha nel suo nucleo IL NUMERO DI MASSA • Il numero di massa (A) è uguale al numero dei protoni addizionato a quello dei neutroni. Questo perchè i protoni ed i neutroni, chiamati nucleoni, sono la maggior parte della massa dell’atomo. Gli isotopi • Gli isotopi sono atomi dello stesso elemento aventi le stesse proprietà chimiche, ma con masse diverse, perchè contengono un diverso numero di neutroni. Il decadimento radioattivo • Il decadimento radioattivo è un processo che trasforma il nucleo di un elemento nel nucleo di un elemento diverso; il processo di emissione di radiazioni è chiamato radioattività.
Scaricare