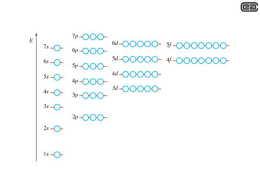
Descrivere la costruzione della configurazione elettronica di un atomo La distribuzione degli elettroni nei vari livelli e sottolivelli (s, p, d, f) si rappresenta con una notazione indicata come configurazione elettronica. Per descrivere la configurazione elettronica, ogni orbitale viene rappresentato convenzionalmente con un quadratino all'interno del quale vanno inseriti gli elettroni, i cui numeri quantici di spin sono rappresentati con frecce verticali rivolte verso l'alto o verso il basso. A ciascun orbitale viene associata una sigla composta da un numero e da una lettera. Il numero indica il numero quantico principale, cioè il livello di energia al quale l'orbitale appartiene e può assumere qualsiasi valore intero compreso tra 1 e 7. La lettera (s, p, d, f) indica il numero quantico secondario e quindi il tipo di orbitale. Ad esempio 1s indica l'orbitale sferico (s) presente nel primo livello di energia. Invece la sigla 2p indica i tre orbitali a doppio lobo (p) presenti nel secondo livello di energia. Per scrivere in modo corretto la configurazione elettronica occorre conoscere l’ordine con cui devono essere riempiti gli orbitali. Questo suddetto ordine di riempimento è basato su tre regole: • • • Principio di Aufbau; Principio di esclusione di Pauli; Principio della massima molteplicità anche detto Regola di Hund. Principio di Aufbau: Il principio prende il nome da un termine della lingua tedesca (Aufbau) che vuol dire costruzione, con una sfumatura di significato che rende il concetto dell’erigere una struttura strato dopo strato. Il principio afferma che gli elettroni si dispongono in un atomo occupando prima gli orbitali liberi con energia minore. L’energia di un orbitale dipende in prima istanza dal suo numero quantico principale n e in secondo luogo dal suo numero quantico secondario l. L’energia aumenta all’aumentare di n; a parità di n l’energia degli orbitali cresce al crescere di l. L’ordine di energia crescente per i primi otto sottolivelli è il seguente: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p,… È opportuno osservare che il riempimento del quarto livello inizia prima del completamento del terzo. L’energia degli orbitali nd è infatti superiore a quella degli orbitali (n+1)s. l’energia degli orbitali nf è superiore a quella di (n+1)p e (n+2)s. La figura riportata di sotto rappresenta l’ordine di riempimento degli orbitali valido per tutti gli elementi della tavola periodica. L’ordine di riempimento può essere ricordato anche seguendo la regola della diagonale: Principio di esclusione di Pauli: Secondo il principio di Pauli, proposto negli anni Venti del secolo scorso dal fisico austriaco Wolfgang Pauli, premio Nobel nel 1945, in un atomo non possono coesistere due o più elettroni che abbiano i quattro numeri quantici uguali. Ogni livello elettronico può contenere soltanto due elettroni, uno con spin su e l’altro con spin giù. Eventuali altri elettroni sonno pertanto costretti a occupare i livelli superiori. Il principio di esclusione di Pauli ha fornito una prospettiva completamente nuova alla formulazione della tavola periodica degli elementi. Esso contribuisce inoltre a spiegare la stabilità su larga scala della materia, fenomeno che interessa oggetti astrofisici come le nane bianche e le stelle di neutroni. Principio della massima molteplicità (regola di Hund): Quando si devono riempire gli orbitali aventi pari energia (degeneri) si colloca un elettrone su ciascun orbitale e poi si completano gli orbitali semipieni. Se ad esempio, dobbiamo inserire tre elettroni nei tre orbitali degeneri 2p, gli elettroni devono essere collocati nel seguente modo: Volendo invece inserire per esempio sette elettroni nei cinque orbitali degeneri 4d, dobbiamo scrivere: Dunque, applicando le tre regole appena viste, possiamo scrivere, a titolo di esempio, la configurazione elettronica dell'ossigeno, avete numero atomico Z = 8 e tenendo conto del fatto che gli esponenti indicano il numero di elettroni che sono collocati in quel tipo di orbitale. Si immagini di costruire tale struttura elettronica partendo dal solo nucleo dell’atomo di ossigeno e aggiungendo gli elettroni uno alla volta. Ogni orbitale si indica con un quadratino, ogni elettrone con una freccia (due frecce con verso opposto indicano due elettroni con numero quantico di spin opposto, ossia antiparalleli). Infine si ottiene:
Scaricare