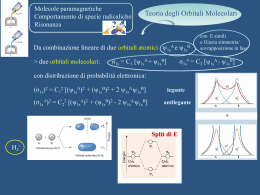
ORBITALI MOLECOLARI Una molecola è dotata di una serie di orbitali detti orbitali molecolari Gli elettroni risiedono negli orbitali molecolari che che, in molti casi casi, sono distribuiti (delocalizzati) su tutta la molecola G. Micera - Chimica Generale ed Inorganica Gli OM si possono interpretare come interferenza costruttiva o distruttiva delle funzioni d’onda atomiche Comportamento ondulatorio dell’elettrone e G. Micera - Chimica Generale ed Inorganica Interferenza delle onde costruttiva o distruttiva G. Micera - Chimica Generale ed Inorganica Rafforzamento della probabilità + + + + Legame Antilegame Diminuzione della probabilità G. Micera - Chimica Generale ed Inorganica Interferenza costruttiva = Orbitale di legame Le funzioni d’onda si sommano punto per punto combinazione in fase (somma) G. Micera - Chimica Generale ed Inorganica Interferenza costruttiva = orbitale di legame La somma si eleva al quadrato: probabilità di trovare l’elettrone ½ (ψA + ψB)2 ψtot2 = ½ (ψA + ψB)2 = ψtot2 ½ [ψA2 + 2(ψA ψB) + ψ B2 ] A B nella zona internucleare la densità elettronica aumenta di + (ψA ψB) G. Micera - Chimica Generale ed Inorganica Gli a G atomi o s si muovono uo o o l’uno u o verso e so l’altro a o e le e funzioni u o d’onda degli elettroni si sovrappongono con la stessa fase, producendo aumento della densitià elettronica tra i nuclei. nuclei L’energia del sistema diminuisce. G. Micera - Chimica Generale ed Inorganica L’aumento di densità elettronica tra i nuclei dovuto alla sovrapposizione in fase riduce l’entità della repulsione tra le cariche positive. Un OM di legame sarà a più bassa energia (più stabile) rispetto a due atomi di H isolati. G. Micera - Chimica Generale ed Inorganica Interferenza distruttiva = orbitale di antilegame Le funzioni d’onda si sottraggono punto per punto combinazione in opposizione di fase ( (differenza) ) G. Micera - Chimica Generale ed Inorganica Interferenza distruttiva = orbitale di antilegame La differenza si eleva al quadrato: probabilità di trovare l’elettrone ½ (ψA - ψB)2 Piano nodale 2 2 ψtot t t = ½ (ψA - ψB) = ½ [ψA2 - 2(ψA ψB) + ψ B2 ] ψtot2 A B nella zona internucleare la densità elettronica diminuisce di (ψA ψB) G. Micera - Chimica Generale ed Inorganica E n e r g i a σ1s σ1s G. Micera - Chimica Generale ed Inorganica Gli orbitali sono di tipo σ: simmetria i t i cilindrica ili d i intorno all’asse internucleare H—H o.m. di antilegame H1s o.m. di legame g Energia G. Micera - Chimica Generale ed Inorganica H1s Per l’interazione di antilegame l’energia aumenta al diminuire della distanza tra i nuclei E σ*1s antilegame legame distanza di legame σ1s Per l’interazione di legame c’è un minimo di energia: la distanza è la distanza di legame, l’energia corrispondente è l’energia di legame G. Micera - Chimica Generale ed Inorganica Orbitale molecolare Combinazione degli orbitali atomici. H2 σ*1s 1s ΔE* ΔE σ1s 1s ΔE* > ΔE La destabilizzazione dell dell’orbitale orbitale di antilega antilegame è maggiore della stabilizzazione dell’orbitale di legame Perciò una molecola di He2 è meno stabile di 2 atomi di He ((ossia non si forma)) G. Micera - Chimica Generale ed Inorganica H2+ H2 σ*1s σ*1s 1s 1s 1s σ1s 1s σ1s Ordine di legame = 0,5 Ordine di legame = 1 G. Micera - Chimica Generale ed Inorganica He2 He2+ o H2- σ*1s 1s σ*1s 1s 1s σ1s 1s σ1s O di di legame Ordine l = 0,5 05 O di di llegame = 0 Ordine G. Micera - Chimica Generale ed Inorganica Li Li2 Li Energ gia σ*2s 2s 2s σ2s σ*1s 1s 1s σ1s Configurazione elettronica 2 2 (σ1s )2(σ2s 1 ) (σ1s 1 *) 2 ) G. Micera - Chimica Generale ed Inorganica Be Be2 Be En nergia σ*2s 2s 2s σ2s σ*1s 1s 1s σ1s Combinazione degli orbitali p (sovrapposizione σ): + + legame antilegame G. Micera - Chimica Generale ed Inorganica σ2ppz σ∗2pz Combinazione degli orbitali p (sovrapposizione π) G. Micera - Chimica Generale ed Inorganica σ**2p F2 π*2p π2p Configurazione elettronica: (σ2s)2(σ2s*)2(σ2p)2(π2p*)4(π2p*)4 OL = (1-1+1+2-2) = 1 σ2p σ*2s σ2s G. Micera - Chimica Generale ed Inorganica σ**2p O2 π*2p π2p Configurazione elettronica: (σ2s)2(σ2s*)2(σ2p)2(π2p*)4(π2p*)2 OL = (1-1+1+2-1) = 1 σ2p σ*2s σ2s G. Micera - Chimica Generale ed Inorganica Uno dei primi successi della teoria dell’orbitale molecolare fu la capacità di spiegare il paramagnetismo di O2 G. Micera - Chimica Generale ed Inorganica σ**2p O 2- π*2p π2p Configurazione elettronica: (σ2s)2(σ2s*)2(σ2p)2(π2p*)4(π2p*)3 OL = (1-1+1+2-1,5) = 1,5 σ2p σ*2s σ2s G. Micera - Chimica Generale ed Inorganica σ*2p N 2 Ne π*2p π2p Configurazione elettronica: ((σ2s)2((σ2s*))2((σ2p)2((π2p*))4((π2p*))4 ((σ2p*))2 OL = (1-1+1+2-2-1) = 0 σ2p σ*2s σ2s G. Micera - Chimica Generale ed Inorganica σ**2p F2 π*2p π2p Configurazione elettronica: (σ2s)2(σ2s*)2(σ2p)2(π2p*)4(π2p*)4 OL = (1-1+1+2-2) = 1 σ2p σ*2s σ2s σ2p In O2, F2, Ne2 gli orbitali sono sufficientemente separati ti π2p π2p σ2p Interazione 2s-2p σ2s Gli orbitali bi li molecolari l l i σ2s e σ2p interagiscono (ovvero si respingono) Risultato: si abbassa la energia g di σ2s e si innalza quella di σ2p σ2s B2, C2, N2 Orbitali Molecolari σ*2p π*2p σ2p π2p 2p 2s orbitali atomici 2p 2s orbitali atomici σ*2s 1s σ2s σ*1s σ1s 1s B2 σ*2p π*2p σ2p π2p σ*2s σ2s G. Micera - Chimica Generale ed Inorganica σ*2p C2 π*2p σ2p π2p σ*2s σ2s σ*2p 2 π *2p N2 σ2p π2p σ*2s σ2s Specie Ordine di legame Lunghezza di legame/ Å Energia di legame/kJ mol-1 H2+ 0,5 1.052 256 H2 1 0 741 0.741 436 H2- 0,5 - 100-200 He2 0 2.97 0.1* Li2 1 2.67 101 Be2 0 - 4 B2 1 1.59 289 C2 2 1.24 599 N2 3 1.10 942 O2 2 1.21 493 O2+ 2,5 1.12 643 O2- 1,5 1.35 395 O22- 1 1.49 9 - F2 1 1.41 155 Ne2 0 3.10 0.2* * Energie dovute alle forze di van der Waals. Waals O3 G. Micera - Chimica Generale ed Inorganica ibridizzazione sp2 dell’ossigeno centrale orbitale p puro ibridizzazione t orbitali tre bit li ibridi ib idi sp2 atomo di O G. Micera - Chimica Generale ed Inorganica ibridizzazione sp2 degli ossigeni terminali orbitale p puro ibridizzazione tre orbitali ibridi sp p2 atomo di O G. Micera - Chimica Generale ed Inorganica Legame π in O3 si combinano 3 orbitali p = 3 orbitali molecolari π antilegame g π non legame atomi di O terminali π legame G. Micera - Chimica Generale ed Inorganica atomo di O centrale Legame π in O3 Enerrgia di antilegame π di non legame g π di legame π gli elettroni di legame sono liberi di muoversi lungo la molecola = delocalizzazione G. Micera - Chimica Generale ed Inorganica Benzene C6H6 G. Micera - Chimica Generale ed Inorganica Energ gia orbitali di antilegame orbitali di legame 3 coppie di elettroni G. Micera - Chimica Generale ed Inorganica B A A A B B B A covalente puro Effetto della elettronegatività G. Micera - Chimica Generale ed Inorganica ionico
Scarica