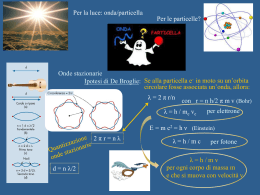
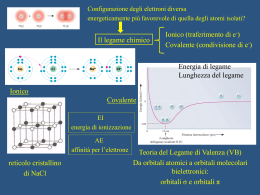
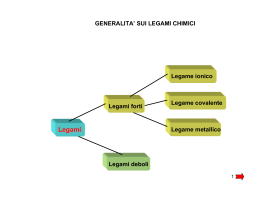
La chimica è la scienza sperimentale che studia la materia e le sue trasformazioni Proprietà e Trasformazioni della MATERIA che avvengono nel mondo MACROSCOPICO dipendono dalla natura della materia che va cercata nel mondo MICROSCOPICO di atomi e molecole !!! Piccole differenze a livello MICROSCOPICO grandi differenze a livello MACROSCOPICO Acido salicilico NATURALE Acido acetilsalicilico Morfina NATURALE Eroina Come si presenta la materia? K2Cr2O7 NaCl KMnO4 CuSO4 5 H2O C (s, grafite) Sb Cu Come procedere? 1. 2. 3. 2 I tre livelli della chimica: macroscopico (osservo e lavoro) microscopico (penso) simbolico (rappresento) STECHIOMETRIA: studio sistematico QUANTITATIVO delle trasformazioni chimiche la mole è il tramite tra microscopico e macroscopico 1 Posso pesare atomi e molecole! m (g) : M (g mol-1) = n (mol) Equazione chimica Reazione chimica 3 COME E’ FATTA LA MATERIA? Thomson e i tubi catodici: la scoperta dell’elettrone Millikan misura carica e massa dell’elettrone Rutherford stima le dimensioni atomiche COME E’ FATTO L’ATOMO? Perché da questo dipendono le proprietà della materia! 1. Dati sperimentali: esperimenti di interazione della luce con la materia – spettri di emissione e di assorbimento 2. Ipotesi di Planck: quantizzazione dell’energia E = n hν 3. Ipotesi di Einstein: natura corpuscolare della luce – il fotone: E = hν 4. Ipotesi di De Broglie: dualismo onda-corpuscolo λ = h / mv 5. Principio di Indeterminazione di Heisenberg: Δp Δx ≥ h / 4π Nasce la Meccanica Quantistica descrive i sistemi microscopici 1. 2. i sistemi microscopici scambiano energia solo in quantità discrete. il moto delle particelle microscopiche è descritto in termini probabilistici. Eq. Fondamentale della Meccanica Quantistica: (-h2 / 8π2m) d2 ψ /dx2 + d2 ψ/dy2 + d2 ψ /dz2 + V ψ = Etot ψ Equazione di Schrödinger * Valori permessi di Energia (Stati stazionari) * Funzioni d’onda ψ (x,y,z) dette ORBITALI definite da una terna di numeri quantici n, l, m con n = 1,2,3… l = 0,… (n-1) m = ±l, 0: 1. ampiezza dell’onda in ogni punto (x,y,z) o (r,θ, φ) dello spazio 2. densità di probabilità per la particella (ψ 2) LA FORMA DELL’ORBITALE Orbitali s (l=0) Orbitali p (px py pz) (l=1) Orbitali d (dxy dyz dxz dx2-y2 dz2) (l=2) INOLTRE per l’elettrone: ms = ± ½ spin elettronico (raddoppia il numero di stati quantici per En : 2n2) TUTTO QUESTO PER ATOMO MONOELETTRONICO!!! E PER GLI ATOMI POLIELETTRONICI? Approssimazione orbitalica del campo autoconsistente di Hartree Orbitali monoelettronici simili a quelli di H: ψnlm con stesse limitazioni per n, l, m MA 1. Modello a gusci (e- con stesso n in guscio di raggio r) e sottogusci (e- con stesso nl in guscio di raggio r) 2. E diverse da quelle per H (e- poco schermati “più vicini” al nucleo, e- molto schermati “più lontani”) 3. Rimozione della degenerazione (nei sottogusci, ns meno schermati di np ed nd, quindi ns più penetranti sul nucleo) Principio di esclusione di Pauli QUINDI: Principio della massima molteplicità Riempimento degli orbitali Configurazioni elettroniche Tavola Periodica degli Elementi EI AE
Scaricare