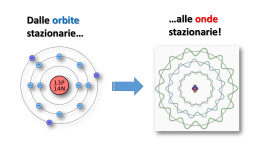
LA STRUTTURA DELL’ATOMO 1) Informazioni generali Atomi idrogenoidi Atomi con un solo elettrone (He+, Li2+,…). La loro struttura può essere discussa esattamente. Atomi multielettronici Atomi (o ioni) con più di un elettrone. Osservazione sperimentale: gli spettri degli atomi idrogenoidi A partire dal 1885 furono individuati diversi insiemi di righe di emissione Nel 1890 Rydberg osservò che tutte righe osservate obbedivano alla relazione 1 1 − ν = RH n2 n2 1 2 RH = 109677 cm-1, n1 = 1, 2,…., n2 = n1+1, n1+2,.. 2) La struttura degli atomi idrogenoidi Si applica il modello del nucleo proposto da Rutherford, il cui potenziale è dato da: V = -Ze2/4πε0r La soluzione della equazione di Schrödinger fornisce le funzioni d’onda dell’atomo di idrogeno ⇒ orbitali. Numeri quantici: a) Numero quantico principale, n=1, 2,… Descrive i livelli energetici dell’elettrone (K,L,M,N,…) b) Numero quantico azimutale, l=0, …, n-1 (s,p,d,f) Descrive il momento angolare dell’elettrone c) Numero quantico magnetico, m= 0, ±1, …, ±l Misura la componente del momento angolare rispetto ad un certo asse (direzione di quantizzazione). d) Numero quantico di spin, s=± ½ Descrive il momento angolare di spin dell’elettrone La soluzione dell’equazione di Schrödinger fornisce i valori dei livelli energetici di una atomo idrogenoide con numero atomico Z: En = − hcR n2 z 2 me e 4 hcR = 32πε 0 h 3) Energia di ionizzazione Energia necessaria per allontanare un elettrone dall’atomo che si trova nel suo stato fondamentale. Per l’atomo di idrogeno vale 13.59 eV. 4) Sottostrati ed orbitali Orbitali caratterizzati dal medesimo valore di n, ma da differenti valori di l formano i sottostrati di un dato guscio. s 1 5) p 3 d 5 f 7 Funzioni d’onda orbitaliche Si ottengono come al solito dalla risoluzione della equazione di Schrödinger e contengono una parte radiale (polinomi di Laguerre) e una parte angolare (polinomi di Legendre, vedi moto rotazionale). es.: parte radiale dell’orbitale 1s 1/ 2 − 1 3 πa ψ 1s = e r a0 La probabilità di trovare un elettrone a una certa distanza dal nucleo, indipendentemente dall’angolo, è data dalla funzione d’onda radiale. Alcuni esempi: 6) Shell e sottoshell Gli orbitali s Numero quantico di momento angolare l=0 Gli orbitali p Numero quantico di momento angolare l=1 Gli orbitali d Numero quantico di momento angolare l=2
Scaricare