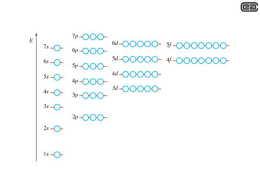
GLI ELEMENTI CHIMICI Gli elementi chimici si indicano con un simbolo, costituito da una e/o due lettere (la prima sempre maiuscola) derivate dal latino. In natura esistono 92 tipi di atomi diversi con un diverso numero atomico , da 1 a 92. Ciascun elemento possiede proprietà fisiche e chimiche diverse. Oltre che per il numero atomico Z, le varie specie di atomi differiscono anche per la massa atomica A. La serie degli elementi naturali inizia con l’atomo dell’idrogeno con un protone e un elettrone che è il più leggero; finisce con l’uranio che possiede 92 protoni e elettroni e 146 neutroni. Cambiando il numero atomico gli atomi sono diversi e cioè hanno proprietà chimiche e fisiche diverse. 8₁₆ O viviamo respirando ossigeno ⁹₁₉F moriremmo respirando fluoro ⁷⁹₁₉₇Au solido a contatto con la pelle non procura danni ⁸⁰₂₀₀Hg liquido pericolosissimo La tavola periodica degli elementi è lo schema con il quale vengono ordinati gli elementi chimici sulla base del loro numero atomico Z e del numero di elettroni presenti nell'orbitale atomico più energetico. E’ stata ideata dal chimico russo Dimitrij Ivanovic Mendeleev nel 1869 inizialmente contava numerosi spazi vuoti. Il numero del gruppo corrisponde al numero totale di elettroni del guscio più esterno occupato 18 GRUPPI 7 PERIODI Lantanidi Attinidi ll numero del periodo corrisponde al numero quantico principale del guscio più esterno occupato LA TAVOLA PERIODICA DEGLI ELEMENTI metallo non metallo numero atomico semi metallo simbolo chimico nome 94Pu massa atomica relativa artificiali solido 7N liquidi 80Hg 8O configurazione elettronica Fe 3134 punto di ebollizione (°C) Ferro 1811 55,8457 7874 punto di fusione (°C) densità (kg/m3) 2He gas 35Br 26 2 8 14 2 9F 10Ne 17Cl 18Ar 36Kr 54Xe 86Rn Mettendo in colonna gli atomi con la stessa configurazione elettronica esterna salta fuori proprio la tavola periodica degli elementi ... ... che Mendeleev aveva costruito, il secolo precedente, basandosi SUL COMPORTAMENTO CHIMICO ! orbitali s orbitali d orbitali p orbitali f LA CONFIGURAZIONE ELETTRONICA DI UN ELEMENTO Ogni orbitale viene rappresentato con un quadratino all’interno del quale vanno inseriti gli elettroni. A ciascun orbitale viene associata una sigla composta da un numero, che rappresenta il numero quantico principale (n=1, 2, 3, 4, 5, 6, 7) e da una lettera, numero quantico secondario (s, p, d, f). Gli elettroni di un atomo sono definiti da 4 numeri quantici, 3 dei quali (n, l, ml) definiscono l’orbitale. Si intende la disposizione degli elettroni sui suoi orbitali Per scrivere la configurazione elettronica di un elemento ci sono 3 regole da seguire IL PRINCIPIO DELLA COSTRUZIONE PROGRESSIVA o di AUFBAU Si occupano prima gli orbitali a più bassa energia e poi quelli a energia più elevata. L’ordine di riempimento si può ricordare seguendo la regola della diagonale IL PRINCIPIO DI ESCLUSIONE DI PAULI In un atomo non possono esistere 2 elettroni aventi gli stessi valori dei 4 numeri quantici. Un orbitale può contenere al massimo 2 elettroni purché di spin opposto REGOLA DI HUND o della MASSIMA MOLTEPLICITA’ Quando si devono riempire gli orbitali aventi la stessa energia si colloca un elettrone su ciascun orbitale e poi si completano gli orbitali semipieni errato corretto SUCCESSIONE ENERGETICA DEGLI ORBITALI L’energia di ogni orbitale è sempre diversa da un altro Tra il livello 3 ed il livello 4 vi è una sovrapposizione dei livelli energetici 6 5 4d 4 Gli elettroni si sistemeranno sempre al livello energetico più basso se non è occupato Nel riempimento elettronico si dovrà procedere cominciando dal livello più basso e procedere verso il successivo 5f 6p 5d 4f 6a 5p 5s 4p E 3 2 1 3d 4s 3p 3s 2p 2s 1s QUANTI n PER 113 ELEMENTI ? 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p 7 x 1 orbitali di tipo s 6 x 3 orbitali di tipo p 4 x 5 orbitali di tipo d 2 x 7 orbitali di tipo f 14 e36 e40 e28 e118 e- Gli orbitali fino a n = 7 sono sufficienti per contenere gli elettroni dei 113 elementi noti IL RIEMPIMENTO DEGLI ORBITALI LA CONFIGURAZIONE ELETTRONICA DI UN ELEMENTO Si intende la disposizione degli elettroni sui suoi orbitali s 7 (Q) 6 (P) 5 (O) 4 (N) 3 (M) 2 (L) 1 (K) p Ogni orbitale viene rappresentato con un quadratino all’interno del quale vanno inseriti gli elettroni. A ciascun orbitale viene associata una sigla composta da un numero, che rappresenta il numero quantico principale (n=1, 2, 3, 4, 5, 6, 7) e da una lettera, numero quantico secondario (s, p, d, f). d f 22Ti titanio 1 s2 2 s2 2 p6 3 s2 3 p6 3 d2 4 s2 Un’ultima considerazione da fare è che, quando un elemento ha un sottolivello d o f con tutti gli orbitali pieni (2 elettroni) ed uno semipieno (1 elettrone), c’è il richiamo di un elettrone dall’orbitale immediatamente superiore, per cui, per esempio, la configurazione elettronica del Rame (Cu 29) sarà: 1s2 2s2 2p6 3s2 3p6 3d10 4s1 e non: 1s2 2s2 2p6 3s2 3p6 3d9 4s2 Lo stesso avviene quando un sottolivello d o f ha tutti gli orbitali semipieni ed uno vuoto, per cui, per esempio, la configurazione elettronica del Cromo (Cr 24), sarà: 1s2 2s2 2p6 3s2 3p6 3d5 4s1 e non: 1s2 2s2 2p6 3s2 3p6 3d4 4s2 Esistono diciotto eccezioni comuni alle configurazioni elettroniche degli atomi nel livello energetico più basso, anche definito stato base. Si discostano dalla regola generale solo nella penultima e terzultima posizione degli elettroni. Cr (..., 3d5, 4s1); Cu (..., 3d10, 4s1); Nb (..., 4d4, 5s1); Mo (..., 4d5, 5s1); Ru (..., 4d7, 5s1); Rh (..., 4d8, 5s1); Pd (..., 4d10, 5s0); Ag (..., 4d10, 5s1); La (..., 5d1, 6s2); Ce (..., 4f1, 5d1, 6s2); Gd (..., 4f7, 5d1, 6s2); Au (..., 5d10, 6s1); Ac (..., 6d1, 7s2); Th (..., 6d2, 7s2); Pa (..., 5f2, 6d1, 7s2); U (..., 5f3, 6d1, 7s2); Np (..., 5f4, 6d1, 7s2) e Cm (..., 5f7, 6d1, 7s2). LA CONFIGURAZIONE ELETTRONICA DI UN ELEMENTO Deviazioni dal principio di Aufbau s 7 (Q) 6 (P) p Alcuni elementi nel riempimento degli orbitali fanno eccezione . • Cr e Mo appartengono al gruppo 6 (6B) • Cu e Ag appartengono al gruppo 11 (1B) d f 24Cr cromo 1 s2 2 s2 2 p6 3 s2 3 p6 3 d5 4 s 29Cu rame 1 s2 2 s2 2 p6 3 s2 3 p6 3 d10 4 s 5 (O) 4 (N) 3 (M) 2 (L) 1 (K) Configurazioni elettroniche a sottolivelli semiriempiti (es. 4s1 3d5) o completamente riempiti (es. 4s1 3d10) • abbassano l’energia dell’atomo • sono più stabili di configurazioni a orbitali semipieni CONFIGURAZIONE ELETTRONICA E GRUPPI Elementi appartenenti allo stesso gruppo hanno la stessa configurazione elettronica esterna Stessa configurazione esterna significa proprietà chimiche simili CONFIGURAZIONE ELETTRONICA E GRUPPI Osservando la tavola periodica, si può vedere una linea spezzata che separa due tipi di elementi: i metalli, che presentano delle caratteristiche particolari, e altri che non le presentano e per questo son chiamati non metalli. Vi sono degli elementi lungo la linea spezzata che presentano caratteristiche intermedie: i semimetalli Elementi appartenenti allo stesso gruppo hanno la stessa configurazione elettronica esterna Stessa configurazione esterna significa proprietà chimiche simili METALLI, NON METALLI e GAS NOBILI hanno molecola monoatomica hanno molecola poliatomica
Scaricare