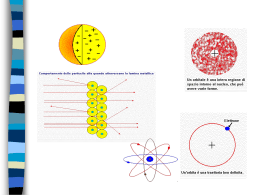
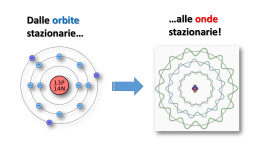
Numeri quantici • numero quantico principale – n = 1 , 2 , ... – energia e distanza dal nucleo • numero quantico di momento angolare – l = 0(s) , 1(p) , 2(d) , ... , n-1 – forma e (un poco) energia • numero quantico magnetico – m = l , l-1 , ... , -l – orientazione • numero quantico di spin s = +½ -½ Struttura elettronica e riempimento degli orbitali Principio Auf-Bau Gli elettroni occupano i livelli ed i sottolivelli elettronici di un atomo in ordine crescente di energia. Principio di esclusione di Pauli In un atomo non possono coesistere due elettroni che abbiano lo stesso set di numeri quantici. Un orbitale può essere occupato da un massimo di due elettroni purchè abbiano spin opposto. Regola di Hund In un gruppo di orbitali isoenergetici (degeneri) nessun orbitale può essere riempito da una coppia di elettroni prima che ciascun sottolivello abbia un elettrone. Spin elettronico Due possibili stati di spin : +1/2 , -1/2 Spin appaiati Spin paralleli Un orbitale può essere occupato da non più di 2 elettroni purchè abbiano spin opposti 10Ne [He]2s22p6 1s22s22p6 11Na [Ne]3s1 [Ne]3s2 [Ne]3s23p1 [Ne]3s23p2 [Ne]3s23p3 [Ne]3s23p4 [Ne]3s23p5 [Ne]3s23p6 [He]2s22p63s1 [Ar]4s1 [Ar]4s2 [Ar]3d14s2 [Ne]3s23p64s1 12Mg 13Al 14Si 15P 16S 17Cl 18Ar 19K 20Ca 21Sc ........ 30Zn 31Ga ........ 36Kr 37Rb [Ar]3d104s2 [Ar]3d104s24p1 [Ar]3d104s24p6 [Kr]5s1
Scaricare