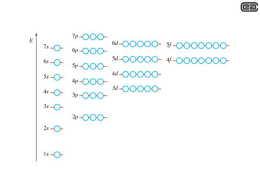
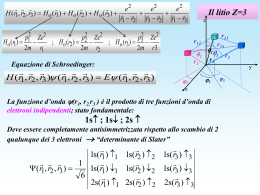
2p+ 2s 1s 2po Il carbonio (Z=6) 2p- configurazione elettronica del C nello stato fondamentale di tripletto di spin - 2 elettroni “equivalenti” nello stato 2p - la funzione d’onda globale deve essere antisimmetrica [He] (2s)2 (2p)2 1 (5,6) (6,5) 2 tripletto di spin, S=1 2 possibilità: 2p+ 2s 1s 2po 2p- configurazione elettronica del C nello stato eccitato di singoletto di spin [He] (2s)2 (2p)2 = parte spaziale antisimmetrica parte di spin simmetrica = parte spaziale simmetrica parte di spin antisimmetrica regola di Hund: il tripletto ha energia minore singoletto di spin, S=0 Il momento angolare totale del carbonio 2p+ 2po 2p- 2s configurazione elettronica del C nello stato fondamentale di tripletto di spin 1s [He] (2s)2 (2p)2 un nuovo problema: come comporre i momenti angolari orbitali in modo da avere una funzione d’onda con la corretta simmetria o antisimmetria spaziale? 3 possibili valori: L5,6 l5 l6 1 1 2p+ 2po 2p- configurazione 2s elettronica del C nello stato eccitato di singoletto di spin 1s [He] (2s)2 (2p)2 L=2 stato D L=1 stato P L=0 stato S P è antisimmetrico tripletto, S=1 3P stato fondamentale EP =-11,3 eV S e D sono simmetrici singoletto, S=0 1D, 1S stati eccitati ED =-10,1 eV ; ES = -8,7 eV Uno stato eccitato interessante 2p+ 2s 1s 2po 2p- configurazione elettronica del C nello stato eccitato con S=2 [He] (2s) (2p)3 la grafite è C allo stato solido, con legame ibrido sp2 il diamante è C allo stato solido, con legame ibrido sp3 -uno stato eccitato molto interessante del carbonio è lo stato con S=2 - favorito in energia per la regola di Hund - 3 elettroni “equivalenti” nello stato 2p, 1 solo elettrone nello stato 2s - il carbonio si comporta come tetravente - energia di legame = -7 eV - è uno stato metastabile nell’atomo isolato - è alla base dei legami ibridi del carbonio nello stato solido e nelle molecole organiche la molecola di benzene Stato fondamentale e stati eccitati del carbonio E (eV) 2s2 2p 3s 1P -3,7 eV 2s2 2p 2s 3P - 3,9 eV 2s 2p3 5S - 7 eV 2s22p2 1S 2s22p2 1D -8,7 eV -10 eV 2s22p2 3P - 11,3 eV S=0 S=1 S=2 Z configurazione simbolo stato fondamentale energia di ionizzazione (eV) s 1 H 1s 13,6 K 2 He (1s)2 24,6 K 3 Li [He] 2s 5,4 L K 4 Be [He] (2s)2 9,3 5 B [He] (2s)2 2p 8,3 L K C [He] (2s)2 (2p)2 7 N [He] (2s)2 (2p)3 14,5 8 O [He] (2s)2 (2p)4 13,6 9 F [He] (2s)2 (2p)5 17,4 10 Ne [He] (2s)2 (2p)6 21,6 11,3 (1s)2 = [He] Regole per il riempimento degli stati nei primi due periodi: L K 6 p Tabella periodica L K L K L K L •principio di esclusione •stato con n minore •a parità di n, stato con l minore •regola di Hund •“gas nobile” al riempimento della shell K L K [He] (2s)2 (2p)6 = [Ne] E (eV) H Li Na 0 4 -1 4s 4p 4d 0 Na Z=11 4d 4p 3d 3d 3p -3 Il sodio -1 3 3s -2 E (eV) 4s 3p 2 - 1 solo -2 elettrone fuori della shell chiusa del -3 [Ne] 2p -4 -4 atomo “alcalino” -bassa energia di ionizzazione E = -5,1 eV -5 3s -5 2s -6 idrogeno - litio - sodio -6 - livelli energetici simili a quelli del Li E (eV) splitting dei livelli del sodio Perché la linea gialla del sodio è sdoppiata? 0 E 10-6eV -1 -2 4d5/2 4d3/2 E 7·10-4eV 4p3/2 3d5/2 4p1/2 E 4s1/2 6·10-5eV 3d3/2 Accoppiamento di spin-orbita: il “buon numero quantico” è il momento angolare totale j dell’elettrone che può avere due valori a parità di l: j=l+1/2 j=l-1/2 -3 E 2·10-3eV -4 -5 3s1/2 -6 3p3/2 Negli atomi, 3p1/2 - l’effetto sull’energia è piccolo (accoppiamento magnetico fra il momento magnetico di spin e il campo magnetico visto dall’elettrone in moto, per effetto della trasformazione di Lorentz del campo coulombiano) - lo stato j=l-1/2 ha energia minore E (eV) principali transizioni radiative del sodio 0 E 10-6eV -1 -2 -3 4d3/2 E 4p3/2 7·10-4eV 3d5/2 4p1/2 3d3/2 E 6·10-5eV 4s1/2 proibita in dipolo elettrico 3p3/2 E 2·10-3eV 3p1/2 -4 -5 3s1/2 -6 4d5/2 praticamente coincidenti in energia linea “D” doppietto giallo del sodio Regole di selezione di dipolo elettrico: l =1 ml = 0, 1 S= 0 ms = 0 j = 0, 1 Z configurazione simbolo stato fondamentale energia di ionizzazione (eV) s 11 Na [Ne] 3s 5,1 M L K 12 Mg [Ne] (3s)2 7,6 M L K 13 Al [Ne] (3s)2 3p 6,0 M L K 14 Si [Ne] (3s)2 (3p)2 8,1 M L K 15 P [Ne] (3s)2 (3p)3 10,5 M L K 16 S [Ne] (3s)2 (3p)4 10,4 M L K 17 Cl [Ne] (3s)2 (3p)5 13,0 M L K 18 Ar [He] (3s)2 (3p)6 15,8 M L K [Ar] 4s 4,3 N M L K 19 K p d Tabella periodica Regole per il riempimento degli stati: •principio di esclusione •stato con n+l minore •a parità di n+ l, stato con n minore •regola di Hund • il “gas nobile” al riempimento dell’orbitale p [Ne] (3s)2 (3p)6 = [Ar] Z configurazione simbolo stato fondamentale energia di ionizzazione (eV) s 19 K [Ar] 4s 4,3 N M 20 Ca [Ar] (4s)2 6,1 N M 21 Sc [Ar] (4s)2 3d 6,5 N M 22 Ti [Ar] (4s)2 (3d)2 6,8 N M 23 V [Ar] (4s)2 (3d)3 6,7 N M 6,8 N M 7,4 N M 4s (3d)5 24 Cr [Ar] 25 Mn [Ar] (4s)2 (3d)5 p d Tabella periodica Regole per il riempimento degli stati: •principio di esclusione •stato con n+l minore 26 Fe [Ar] (4s)2 (3d)6 7,9 N M 27 Co [Ar] (4s)2 (3d)7 7,9 N M •a parità di n+ l, stato con n minore 28 Ni [Ar] (4s)2 (3d)8 7,6 N M •regola di Hund 29 Cu [Ar] 4s (3d)10 7,7 N M 30 Zn [Ar] (4s)2 (3d)10 9,4 N M •il “gas nobile” al riempimento dell’orbitale p 31 Ga [Ar] (4s)2 (3d)10 4p 6,0 N M volumi atomici energie di ionizzazione . n=3, l=2 n=4, l=2 n=5, l=2 n=6, l=2 n=4, l=3 n=5, l=3 Come leggere la tavola periodica Esempio: il polonio (Po); Z=84 . - ha il guscio interno dello Xe, che comprende la configurazione elettronica di 54 elettroni -è nel gruppo dell’O, 4 periodi sotto: (6p)4 - ha davanti 10 stati dell’orbitale 5d: (5d)10 - davanti ancora 14 stati dell’orbitale 4f: (4f)14 -davanti ancora 2 stati dell’orbitale 6s: (6s)2 [Xe](6s)2(4f)14(5d)10(6p)4 E (keV) L edge 0 2 M M edge n 4-N 3-M 2-L L L 4 K K K 8 K edge 6 Legge di Moseley: f = A(Z-c) con A2 11/h eV 10 12 Raggi X: spettri di emissione di un atomo con Z 30 c1 1-K sdoppiamenti di “struttura fine” 4-N V IV III II I 3-M 2-L L L III II I 2d 5/2 2d 3/2 2p 3/2 2p 1/2 2s 1/2 2p 3/2 2p 1/2 2s 1/2 j=l+1/2 j=l-1/2 j=l+1/2 j=l-1/2 j=l+1/2 j=l-1/2 Raggi X: struttura fine degli spettri di emissione di un atomo con Z 30 1-K K K K 4-N V IV III II I 3-M M 2-L L III II I 2d 5/2 2d 3/2 2p 3/2 2p 1/2 2s 1/2 2p 3/2 2p 1/2 2s 1/2 Raggi X: spettri di assorbimento di un atomo con Z 30 1-K K Modello a shell nei nuclei Energia Accoppiamento di spin-orbita: 1d 2s 1p 1s 3/2 20 1/2 5/2 16 14 1/2 8 3/2 6 1/2 j Ca20 il “buon numero quantico” è il momento angolare totale j del nucleone (protone o neutrone), che può avere due valori a parità di l: j=l+1/2 j=l-1/2 O8 2 Nucleo Z “magico” Nei nuclei, - l’effetto sull’energia è grande - lo stato j=l-1/2 ha energia maggiore
Scaricare