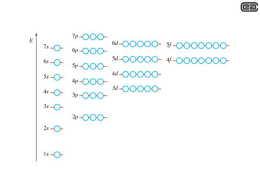
Chimica 2 (07/08) I RADICALI Per riuscire a comprendere bene che cos'è un radicale dobbiamo partire dalla descrizione della natura dei legami chimici. Abbiamo visto come si forma un legame covalente ed abbiamo visto che la formazione di un legame è dovuta al fatto che i due atomi che si legano fra di loro ottengono uno stato di energia potenziale minore rispetto allo stato in cui si trovano separati. Se quindi forniamo energia ad una molecola biatomica possiamo fare in modo che i due atomi legati tra di loro si separino e che quindi la molecola si dissoci in due atomi. L'energia che dobbiamo fornire viene chiamata energia di dissociazione del legame (bond dissociation energy: BDE) e si indica con BDE(-) dove "" rappresenta l'atomo legato. Come conseguenza se due atomi si uniscono a formare tale legame, l'energia che viene emessa è esattamente uguale a questa quantità. Nel caso in cui si ha la formazione di un legame covalente la formazione del legame e quindi il guadagno di energia è dovuto alla messa in comune di due elettroni (uno per ogni atomo) in quanto l'energia dei due elettroni associati insieme ai due nuclei è minore dell'energia dei due elettroni associati separatamente ognuno ad un nucleo. Un legame di questo tipo che si formi tra due atomi diversi A e B si può rompere in tre diversi modi: o L'atomo A può prendere tutti e due gli elettroni e poiché gli elettroni sono cariche negative avremo: AB → A* + B) o L'atomo B può prendere tutti e due gli elettroni AB → A) + B* o Ognuno dei due atomi prende un elettrone AB → A + B Le specie cariche che si formano nei primi due casi vengono dette ioni e la rottura del legame si dice eterolisi, mentre le specie che si formano nel terzo caso vengono dette radicali e la rottura del legame si dice omolisi. I radicali sono le specie che si formano dalla rottura emolitica di un legame covalente e sono quindi specie caratterizzate dalla presenza di un elettrone spaiato (numero dispari di elettroni). Il modo energeticamente più favorevole di rompere un legame è sempre l'omolisi. Anche il cloruro di sodio, che è un tipico composto ionico, se venisse riscaldato in fase gassosa si dissocerebbe in maniera emolitica; in soluzione però, specialmente se il sovente è polare, esso si dissocia in ioni Na) e ioni Cl* in quanto gi ioni vengono stabilizzati dalla presenza delle molecole di solvente che li circondano formano una sorta di gabbia di solvente. L'interazione tra gli ioni e le molecole di solvente, detta solvatazione, abbassa l'energia potenziale ed è il fattore che controlla le reazioni in soluzione. La solvatazione può essere importante anche se non si formano specie cariche ma gli intermedi di reazione sono fortemente polarizzati. Nel caso del cloruro di sodio gli ioni ioni Na) e gli ioni Cl* rimangono separati in quanto l'energia potenziale si abbassa di più con la solvatazione che con il riformarsi del legame tra ioni Na) e ioni Cl*. I radicali non vengono solvatati nello stesso modo degli ioni. La tipica solvatazione avviene infatti per interazione elettrostatica tra cariche elettriche. Per solvatare i radicali, servirebbe un solvente contenente elettroni spaiati (singoli elettroni in un orbitale) e di norma i solventi hanno tutti gli elettroni accoppiati così che l'interazione tra un radicale e 1-1 Chimica 2 (07/08) un solvente è molto piccola. Questo comporta che non si può formare una robusta gabbia di molecole di solvente intorno ad un radicale e quindi essi possono ricombinarsi facilmente tra di loro per riformare una molecola. Questo è il motivo per cui è possibile avere alte concentrazioni di ioni in solventi polari come l’acqua, mentre non possiamo ottenere alte concentrazioni di radicali in soluzione. In generale i radicali sono quindi specie transienti con un tempo di vita molto corto; esistono però alcuni radicali, chiamati “radicali persistenti” che possono esistere puri allo stato liquido o solido in virtù delle loro caratteristiche elettroniche e di struttura. I radicali sono quindi sostanze che possiedono un elettrone spaiato e che contengono quindi un numero dispari di elettroni. Due esempi di questo tipo sono l’ossido di azoto (monossido di azoto) e il biossido di azoto (diossido di azoto). L’ossido di azoto ha una scarsa tendenza a dimerizzare in fase gassosa, ma il biossido di azoto è in equilibrio con il suo dimero, il tetrossido di diazoto. N O O N O Stabilità dei radicali al carbonio La stabilità di un radicale è una proprietà termodinamica che misura la sua energia: tanto più bassa è l’energia di un composto e tanto più esso è stabile. Vista l’impossibilità di misurare in modo assoluto l’energia di un composto essa viene però misurata in termini di forza del legame R-H del radicale (R•) in questione con un atomo di idrogeno: tanto maggiore sarà la forza del legame R-H e tanto minore sarà la stabilità del radicale in quanto evidentemente esso viene notevolmente stabilizzato (abbassa la sua energia) dalla formazione del legame con un atomo di idrogeno. Il confronto delle BDE(R-H) dei diversi radicali ci può quindi dare un’idea della stabilità di ognuno di essi rispetto ad un altro. Tipo Legame BDE (kcal mol-1) R CH CH 76 CH H Bis-allilico Allilico R CH R CH CH CH CH H 85 R Benzilico CH2 H Perossidico Tiilico ROO H H3C S H Terziario R C R 88 88 92 93 H R Secondario R CH Primario R R Metilico H H H3C H CH2 Fenilico Idrossilico 96 H H H HO H 100 104 105 111 119 1-2 Chimica 2 (07/08) Nella figura riportata sotto vengono descritti i tipi più comuni di radicali in ordine di stabilità: partiamo dal radicale trifenilmetile, per proseguire con il radicale benzile e l’allile e per arrivare ai radicali alchilici (terziario, secondario primario, metilico); infine troviamo i radicali vinilici e fenilici. . . CH2 C > Trifenilmetilico H3C CH . > H2C C CH2 H ˜ Benzilico H3C C . > CH3 Allilico Terziario . CH3 > CH3 . > . . H3C CH2 Secondario > Primario . CH3 > H2C CH Metilico ˜ Vinilico Fenilico I primi tre radicali devono la loro stabilità al fenomeno della risonanza: tante più forme di risonanza possiede una certa struttura e tanto più essa è stabile. Per il radicale trifenilmetilico si possono scrivere molte forme in cui l’elettrone spaiato sia delocalizzato dal carbonio centrale a quelli orto e para degli anelli benzenici: l’alto grado di delocalizzazione rende il prodotto molto stabile (10 forme di risonanza); meno stabili saranno di conseguenza il radicale benzilico (4 forme di risonanza) e quello allilico (2 forme di risonanza identiche). . CH2 . CH2 CH2 . . H C H C CH H2C CH2 H2 C CH2 I radicali alchilici non possiedono forme di risonanza e sono quindi di conseguenza meno stabili; il loro ordine di stabilità (radicale terziario > radicale secondario > radicale primario, radicale metilico) è dovuto al fenomeno dell'iperconiugazione che consiste in una delocalizzazione degli elettroni attraverso legami σ anziché π (le forme iperconiugative possono portare al trasferimento dell’elettrone solamente su atomi di idrogeno). H H C CH2 H H H C CH2 H H H C CH2 H H H C CH2 H Paramagnetismo e spin elettronico. 1-3 Chimica 2 (07/08) Una delle caratteristiche dei radicali e che sono paramagnetici. Vediamo in che cosa consiste tale caratteristica. Gli elettroni che si muovono intorno al nucleo, formano delle correnti elettriche e quindi dei campi magnetici. Nel caso in cui una specie venga sottoposta ad un campo magnetico esterno l’energia dei due stati di spin, che possono assumere gli elettroni in ogni orbitale, che in condizioni normali sono degeneri, viene modificata a causa dell’interazione del campo magnetico esterno con quello generato dall’elettrone. Elettroni che abbiano spin opposto generano campi magnetici di polarità invertita, per cui, se il numero di elettroni con spin ½ è uguale a quello degli elettroni con spin -½ non si avrà alcun effetto mentre se uno dei due spin prevale sull’altro si avrà un campo magnetico risultante. La presenza di elettroni spaiati può essere quindi rilevata tramite l’interazione con un campo magnetico. Nel caso in cui si verifichi la prima ipotesi (tutti gli elettroni accoppiati) la sostanza si dice diamagnetica, mentre nel secondo caso (uno o più elettroni spaiati) si dice paramagnetica. Lo stato di tripletto Ci sono inoltre sostanze che nonostante abbiano un numero pari di elettroni, come ad esempio l’ossigeno, sono ugualmente paramagnetiche. Per capire il paramagnetismo dell’ossigeno dobbiamo andare a vedere come si dispongono gli elettroni negli orbitali all’interno di una molecola e quindi analizzare il caso particolare dell’ossigeno. Gli atomi sono costituiti da nuclei carichi positivamente circondati da elettroni carichi negativamente. Gli elettroni occupano gli orbitali atomici ad ognuno dei quali è associata una determinata energia. Un atomo neutro contiene tanti elettroni quanti ne occorrono per bilanciare la carica del nucleo. Così il nucleo del carbonio contiene 6 protoni ed è circondato da 6 elettroni che occupano 4 orbitali atomici. Gli elettroni occupano gli orbitali a più bassa energia disponibili e si accoppiano con spin antiparallelo. Quando ci sono disponibili due o più orbitali alla stessa energia (degeneri) gli elettroni preferiscono disporsi con spin parallelo uno per orbitale piuttosto che accoppiarsi (regola di Hund). Quando due atomi si legano tra loro gli orbitali atomici si combinano, si mescolano, per formare orbitali molecolari e gli elettroni si dispongono su questi ultimi rispettando le stesse regole. Gli orbitali molecolari di legame possono essere di tipo σ o di tipo π e per ogni orbitale molecolare di legame che si forma si forma un orbitale molecolare di antilegame (si combinano due orbitali atomici, si devono formare due orbitali molecolari) che si trova ad alta energia e rappresenta uno stato repulsivo e viene contraddistinto da un asterisco. L'ordine delle energia per gli orbitali molecolari che si formano quando si legano due atomi uguali del secondo periodo è quello mostrato in figura. Per semplificare le cose non teniamo conto del fenomeno dell'ibridazione. 1-4 Chimica 2 (07/08) Nel caso dell’ossigeno gli atomi che si vanno a legare fra di loro hanno ognuno 8 elettroni (stiamo considerando anche gli elettroni del guscio interno) e la situazione che si viene a creare è la seguente: gli elettroni che erano negli orbitali 1s (2 + 2) riempiono l’orbitale molecolari di legame 1σs e l’orbitale molecolare di antilegame 1σs*; gli elettroni che erano negli orbitali 2s (2 + 2) riempiono l’orbitale molecolari di legame 2σs e l’orbitale molecolare di antilegame 2σs*; gli elettroni che erano negli orbitali 2p (4 + 4) riempiono completamente l’orbitale molecolare di legame 2σp e i due orbitali molecolari di legame 2πp e parzialmente i due orbitali molecolari di antilegame 2πp* con due elettroni a spin parallelo. E’ la presenza di questi due elettroni spaiati che causa il paramagnetismo dell’ossigeno. Inoltre i due elettroni spaiati controllano anche il comportamento chimico dell’ossigeno che si comporta come un biradicale stabile. Le molecole che hanno due elettroni spaiati con spin parallelo vengono detti tripletti. Le molecole come l’ossigeno che sono dei tripletti allo stato fondamentale sono rare ma spesso molecole in uno stato eccitato sono tripletti. 1-5 Chimica 2 (07/08) LA STORIA Nella storia della chimica i radicali sono una realtà abbastanza recente. Il primo vero radicale libero è stato preparato solamente all’inizio del 20 secolo, e il fatto che i radicali giocassero un ruolo importante nelle reazioni chimiche è stato riconosciuto solo trent’anni dopo. Essendo delle specie che portano degli elettroni spaiati, i radicali sono specie molto reattive ed in generale capaci di esistere solamente come specie transienti. Così non ci si deve meravigliare se, nonostante ci sia stato un grande interesse a produrre ed isolare dei radicali, non ci si sia riusciti fino al 1900 quando Moses Gomberg generò per la prima volta il suo famoso trifenilmetil radicale, e produsse evidenze sperimentali, per confermare le sue affermazioni. Passarono circa 28 anni prima che i semplici metil ed etil radicale venissero preparati. Questi radicali, venne dimostrato che esistono solo per una frazione di secondo. Il riconoscimento che i radicali partecipassero come entità reagenti nelle reazioni chimiche avvenne però solamente nel 1937 da parte di Kharasch e Flory negli Stati Uniti e Hey e Waters in Inghilterra; si aprì quindi una nuova era nella quale si cominciò a tenere conto della possibile partecipazione dei radicali come specie reagenti nelle reazioni chimiche. Questo portò ad interpretare delle reazioni che finora erano state viste come processi degradativi come delle vere e proprie reazioni chimiche, come la pirolisi dei composti organici che veniva usata solamente per distruggere i composti naturali e determinarne la loro composizione chimica, o i processi ossidativi di deterioramento dei composti. Inoltre, diverse reazioni che era stato dimostrato che avvenissero con dei meccanismi ionici, ma che mostravano dei comportamenti anormali in determinate condizioni, venne dimostrato che in tali condizioni seguivano un meccanismo di tipo radicalico che poteva spiegare il comportamento altrimenti considerato anomalo. Un esempio di questo tipo è la reazione di addizione di acido bromidrico agli alcheni. Questo riconoscimento dei radicali liberi quali partecipanti nelle reazioni chimiche ha avuto notevoli conseguenze nella chimica organica. Da un verso, si scoprì un nuovo campo di investigazione, e la ricerca di nuove reazioni che coinvolgessero radicali liberi ne fu l'immediata conseguenza. Dall'altro, e questo fu forse di maggiore fondamentale importanza, si aprì un nuovo modo di interpretare dal punto di vista teorico i fenomeni chimici. I radicali derivano da uno dei due modi fondamentali nei quali si può rompere un legame covalente, e così, poiché finora i chimici avevano considerato esclusivamente dei reagenti ionici nello studio del comportamento dei composti chimici, i loro studi erano per metà incompleti non avendo preso in esame anche l'effetto di reagenti radicalici. Lo sviluppo della chimica dei radicali portò ad un grande sviluppo della chimica del petrolio. Fino al 19simo secolo per i chimici gli idrocarburi saturi sembravano essere privi di reattività chimica così che vennero chiamati paraffine che significa di poca affinità. Questi studiosi, d'altra parte usarono solo reagenti ionici (acidi, basi ed affini) su questi composti, mentre al contrario, questi idrocarburi reagiscono con grande avidità se vengono attaccati da reagenti radicalici, dando origine a reazioni a catena caratteristiche delle reazioni dei radicali in generale. La maggior parte delle reazioni caratteristiche di questi composti inoltre sono applicabili a tutti i composti organici, e lo studio del meccanismo di tali reazioni portò ad una nuova prospettiva nella teoria delle reazioni 1-6 Chimica 2 (07/08) organiche. Per fare alcuni esempi di queste reazioni radicaliche, specialmente quelle che hanno utili applicazioni nella vita di tutti i giorni, si può menzionare lo studio dei processi chimici denominati combustione e il conseguente sviluppo degli antidetonanti e di altri additivi che aiutano il processo di combustione. Dallo studio del processo denominato autossidazione abbiamo capito come i grassi e gli oli, ed altri generi alimentari si deteriorano e si sono sviluppati gli antiossidanti e gli inibitori che ritardano questi processi chimici e che vengono usati come conservanti nei cibi. Inoltre, lo stesso tipo di reazione è responsabile della decomposizione di alcuni reagenti chimici ed anche dell'invecchiamento delle gomme. Nonostante l'autossidazione sia spesso un problema e devono essere prese misure speciali per bloccarlo, in alcune occasioni esso può essere usato positivamente. Per esempio l'ossidazione aerobica del cumene, fatta su scala industriale produce il fenolo e l'acetone usati come antisettici. L'asciugatura delle vernici e delle pitture è anch'esso un processo che coinvolge i radicali liberi e le ricerche in questo campo hanno portato alla scoperta di nuovi materiali che perseguono specifiche richieste. Ancora il cosiddetto processo di cracking cioè la pirolisi sotto condizioni controllate, rompe le molecole degli idrocarburi del petrolio per produrre carburanti per motori. Al contrario il processo della polimerizzazione, attraverso il quale piccole molecole vengono legate insieme per formare molecole ordinate giganti viene usato per numerosi scopi. Un cenno va anche fatto ad un gruppo di reazioni radicaliche, che avvengono in fase liquida o di vapore, che vengono iniziate per irraggiamento con la luce del sole o ultravioletta o con i raggi γ, che provoca la rottura di legami covalenti per generare radicali. Questo riassunto di reazioni radicaliche non sarebbe completo senza un richiamo al ruolo dei radicali nelle reazioni che avvengono nei sistemi biologici. Questo è stato il soggetto di lunghe speculazioni per molto tempo ma tale studio non ha ottenuto grandi successi fino ad un passato più recente, e specialmente fino allo sviluppo della tecnica della risonanza elettronica di spin. L'importanza del problema risulta evidente dalla lista dei processi biologici nei quali i radicali liberi si sono dimostrati attivi partecipanti attraverso questa nuova tecnica. Questi includono l'ossidazione e la riduzione enzimatica, l'invecchiamento cellulare, la fotosintesi, la chemiluminescenza, il danno alle cellule per irraggiamento e l'inizio di crescite maligne. 1-7
Scaricare