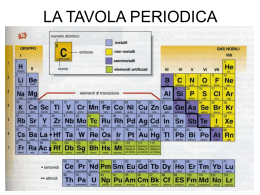
CORSI DI RECUPERO 2012 Classi terze L.S.T. Docente: Luciano Canu TAVOLA PERIODICA La tavola periodica degli elementi È una tabella che raccoglie e rappresenta tutti gli elementi conosciuti Rappresenta: ogni elemento è rappresentato con una casella che contiene il suo simbolo Raccoglie: Ordine di numero atomico Per gruppi (somiglianza chimica – configurazione di valenza) Metalli e non metalli Per periodi (mettono l’ultimo elettrone in quel livello) STRUTTURA ELETTRONICA DELL’ATOMO Numero e disposizione degli elettroni all’interno dell’atomo Numero atomico (Z): numero di protoni presenti in quell’elemento Non basta conoscere il numero totale degli elettroni Per un atomo neutro, quindi, anche il numero degli elettroni è uguale a Z Gli elettroni si dispongono secondo schemi piuttosto complessi attorno al nucleo Una versione semplificata dispone gli elettroni secondo livelli energetici principali A ciascun livello è associato un numero intero diverso da 0 chiamato numero quantico principale (n) Ad n è associata l’energia del livello (si può calcolare) Maggiore è n maggiore è l’energia del livello GLI ELETTRONI ED I LIVELLI Gli elettroni sono indistinguibili Acquisiscono l’energia del livello in cui si trovano L’energia dei livelli è quantizzata e stabilisce la distanza permessa di ogni livello e quindi di ogni elettrone La teoria della quantizzazione dell’energia afferma che esiste una quantità minima di energia (quanto) tutta l’energia è scambiata in multipli del quanto fondamentale (fotone) Bohr aveva utilizzato la teoria quantica per spiegare la stabilità dei livelli e degli elettroni associati LIVELLI ELETTRONICI SEMPLIFICATI È possibile rappresentare in modo semplice la configurazione elettronica dei primi 20 elementi della tavola 1 + - - - - 7 + - 3 + 2 + - - - - 4 + - - - - 6 + 5 + - - - - - - - -
Scaricare