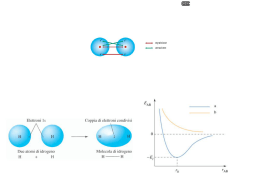
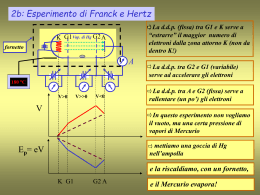
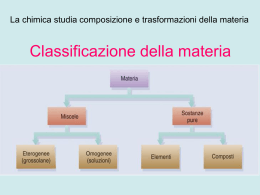
FORMULA DI STRUTTURA Regole: • 1) individuare l’atomo centrale, (l’atomo di carbonio è sempre centrale, nei composti il non-metallo con minore elettronegatività è l’atomo centrale); • 2) si sommano tutti gli elettroni di valenza e si dividono per due. • 3) si legano gli atomi periferici all’atomo centrale con legami singoli; • 4) con le coppie di elettroni non utilizzati si completa l’ottetto degli atomi periferici e se rimangono delle coppie non utilizzate si aggiungono all’atomo centrale come coppie di non legame; • 5) quando l’atomo centrale è diverso da H, Hg, elementi del IIIA e non possiede un ottetto, gli atomi periferici condividono le loro coppie di non legame per formare legami multipli; • 6) se tra gli atomi periferici c’è l’ossigeno, l’atomo centrale è obbligato a raggiungere l’ottetto; • 7) quando l’atomo centrale è un elemento di un periodo superiore al secondo, se ci sono atomi di ossigeno periferici, questo può espandere l’ottetto coinvolgendo gli orbitali d, e forma fino a due legami doppi. (12 elettroni al massimo, ricorda H si lega quasi sempre all’O). H2CO3 Elettroni di valenza: H =1 ; C= 4 O=6 H =1 ; O=6 O=6 Totale elettroni = 24 24/2= 12 O O H O H C H2SO4 Elettroni di valenza: H =1 ; S= 6 O=6 H =1 ; O=6 O=6 O=6 Totale elettroni = 32 32/2= 16 O O H O H S O HNO3 Elettroni di valenza: H =1 ; N= 5 O = 6 O=6 O=6 Totale elettroni = 24 24/2= 12 L’azoto non può espandere l’ottetto. O H O N O HClO3 Elettroni di valenza: H =1 ; Cl= 7 O = 6 O=6 O=6 Totale elettroni = 26 26/2= 13 O H O Cl O H3PO4 H =1 Elettroni di valenza: H =1 ; P= 5 O = 6 H =1 O=6 Totale elettroni = 32 32/2= 16 O=6 O=6 O O H O H P H O HClO2 Elettroni di valenza: H =1 ; P= 7 O=6 O=6 Totale elettroni = 20 20/2= 10 H O Cl O Fine
Scaricare