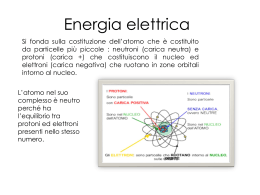
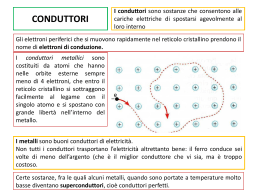
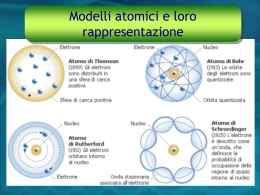
2b: Esperimento di Franck e Hertz La d.d.p. (fissa) tra G1 e K serve a “estrarre” il maggior numero di elettroni dalla zona attorno K (non da dentro K!) K G1 Vap. di Hg G2 A fornetto (Vuoto) A La d.d.p. tra G2 e G1 (variabile) serve ad accelerare gli elettroni 180 °C V>0 V>>0 V<0 V La d.d.p. tra A e G2 (fissa) serve a rallentare (un po’) gli elettroni In questo esperimento non vogliamo il vuoto, ma una certa pressione di vapori di Mercurio mettiamo una goccia di Hg nell’ampolla Ep= eV e la riscaldiamo, con un fornetto, K G1 G2 A e il Mercurio evapora! Cosa faranno gli elettroni al crescere della pressione? Gli elettroni urteranno gli atomi di Hg. Con che esito? Si tenga conto che me 2.7x10-6mHg Se gli atomi di Hg si comportassero come sfere dure, si avrebbe un urto elastico = l’energia cinetica, Ek , si conserverebbe (potrebbe cambiare la direzione della velocità, ma non il suo modulo) Hg vi vf vi = vf Però, potrebbe esistere un meccanismo interno all’atomo che si innesca solo ad una certa energia E1. Allora, per EK = E1 l’atomo assorbirebbe l’energia E1 , che verrebbe persa dall’elettrone, che si fermerebbe! EK= E1 Hg Hg V>0 V>>0 V<0 V Ep= eV E1 E1 Ek= 1/2mv2 E1 K G1 G2 A Grafico I-V I Nessun assorbimento VGG Assorbimento a “soglia” I E1= eV1 Assorbimento a “finestra” VGG DV I V1 DV E1= eDV VKG1 V0 DV V1 V2 VGG Spiegazione secondo l’ipotesi di Bohr del modello planetario di Rutherford Ea Eb Un elettrone che “ruota” attorno al nucleo non può occupare “orbite” di raggio (energia) qualunque, ma solo orbite di raggio definito. Quindi per passare da un’orbita a quella di energia superiore, l’elelttrone deve assorbire una ben determinata quantità (quanto) di energia: Eb –Ea = E1 = eDV1 Cosa succede nell’atomo dopo l’assorbimento di energia (eccitazione)? L’atomo dopo l’assorbimento di energia si diseccita, riemettendo l’energia sotto forma di fotoni (luce).
Scaricare