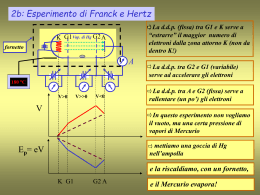
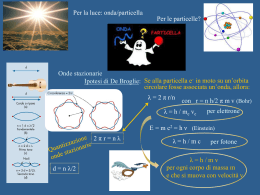
7. L’Atomo • • • • • Le Caratteristiche della Luce Quanti e Fotoni Spettri Atomici e Livelli Energetici L’Atomo di Bohr I Modelli dell’Atomo - Orbitali atomici - I numeri quantici e gli orbitali atomici - Lo spin elettronico • Atomi Multielettronici - L’energia degli orbitali - La costruzione a strati e la configurazione elettronica • Il Carattere Periodico delle Proprietà Atomiche - Raggio atomico, energia di ionizzazione, affinità elettronica Le Caratteristiche della Luce Li Na K Ca Ba Sr righe spettrali La LUCE è una RADIAZIONE ELETTROMAGNETICA c = 3.00x108 m∙s-1 Cu Le Caratteristiche della Luce La LUCE è una RADIAZIONE ELETTROMAGNETICA c = 3.00x108 m∙s-1 campo elettrico Def. La FREQUENZA, n, è il numero di cicli, ovvero di inversioni complete al secondo [1 Hz = 1 s-1] Lunghezza d’onda l Def. La LUNGHEZZA D’ONDA, l, è la distanza tra un massimo/minimo e quello successivo lxn=c Quanti e Fotoni FOTONE ELETTRONE METALLO Max Planck Numero elettroni Intensità raggio incidente En. cinetica elettroni NON dipende da Intensità L’ENERGIA non è solo un’onda che si propaga in modo continuo e in tutte le direzione, ma è emanata a proiettili, ovvero QUANTI predefiniti dello stesso valore. La LUCE si comporta sia come ONDA, quindi soggetta a fenomeni di rifrazione, che come PARTICELLA. La particella di luce è chiamata FOTONE. E = h∙n h = costante di Planck Frequenza/1014 Hz Energia a fotone/10-19 J Ultravioletto 8.6 5.7 Infrarosso 3.0 2.0 Spettri Atomici e Livelli Energetici Atomo di H E L’ATOMO DI H, ESISTE IN UNA SERIE DISCONTINUA DI STATI, DETTI LIVELLI ENERGETICI L’Atomo di Bohr •Rutherford 1908: nucleo “massivo” con cariche positive. •Bohr 1913: l’elettrone dell’atomo di H ruota intorno al nucleo, descrivendo un’orbita circolare. r F = ma Forza Coulombiana e2 r2 Accelerazione Centripeta = v2 m r e2 r mv 2 v e mr Energia Totale = Energia Cinetica + Energia Potenziale 1 e2 1 e2 e2 1 e2 2 E mv 2 r 2 r r 2 r POSTULATO DELLA QUANTIZZAZIONE DELLA QUANTITÀ DI MOTO h h2 mv r n n 1,2,3,..., r 2 2 e h 1 2 4 me n e h 1 mr 2 mr 2 2 4 v v n 1 e 1 2 me mr 2 mr E 2 2 r n h2 L’Atomo di Bohr h2 r 4 2me2 1 e2 1 2 2me4 E 2 2 r n h2 n = numero quantico STATO QUANTICO 2^ POSTULATO L’ATOMO EMETTE O ASSORBE ENERGIA SOTO FORMA DI RADIAZIONI ELETTROMAGNETICHE SOLO QUANDO SI VERIFICANO DELLE TRANSIZIONI, CIOÈ PASSAGGI TRA STATI QUANTICI DIVERSI, E L’ENERGIA CORRISPONDENTE ALLA DIFFERENZA TRA I LIVELLI ENERGETICI PROPRI DEGLI STATI QUANTICI TRA I QUALI AVVIENE LA TRANSIZIONE CONSIDERATA È EMESSA O ASSORBITA SOTTO FORMA DI UN UNICO FOTONE. E En En' hn E En ' n n h LEGGE DI BOHR I Modelli dell’Atomo •Bohr 1913: l’elettrone dell’atomo di H ruota intorno al nucleo, descrivendo un’orbita circolare. •Heisenberg 1927: principio di indeterminazione. The more precisely the position is determined, the less precisely the momentum is known in this instant, and vice versa. Heisenberg, uncertainty paper, 1927 r PROBABILITÀ •de Broglie 1924: anche gli elettroni sono caratterizzati da dualismo onda-particella. MECCANICA CLASSICA MECCANICA ONDULATORIA Gli Orbitali Atomici •Edwin Schrödinger 1926 EQUAZIONE di SCHRÖDINGER NUMERI QUANTICI n, l, ml FUNZIONE D’ONDA = ORBITALE LIVELLO ENERGETICO L’orbitale atomico è associato alla regione di spazio nella quale è più probabile rinvenire l’elettrone. SUPERFICIE DEI CONTORNI MECCANICA CLASSICA MECCANICA ONDULATORIA traiettoria probabilità EQUAZIONE DI SCHRÖDINGER ORBITALE numeri quantici Gli Orbitali Atomici Numero quantico principale n = 1, 2, 3, …, ∞ Numero quantico azimutale l = 0, 1, 2, …, n-1 Numero quantico magnetico ml = -l, -l+1, …, 0, …, l-1, +l n l ml n=1 l=0 s 0 1s l=0 s 0 2s l=1 p -1 0 +1 l=0 s 0 l=1 p -1 0 +1 l=2 d -2 -1 0 +1 +2 s n=2 n=3 strato sottostrato 2p 3s orbitale 3p 3d Lo Spin Elettronico Samuel Goudsmit George Uhlenbeck Numero quantico di spin ms 1 2 1 2 Gli Atomi Multielettronici ATTRAZIONE NUCLEO - ELETTRONE REPULSIONE ELETTRONE - ELETTRONE STRUTTURA ELETTRONICA carica carica 1 ENERGIA POTENZIALE ENERGIA CINETICA mv2 r 2 ETOT ENERGIA POTENZIALE ENERGIA CINETICA E↑ 4s 3d 3p 3s 2p 2s + Li: 3e1s Il Principio della Costruzione a Strati n, l, ml, ms STATO FONDAMENTALE configurazione corrispondente alla minima energia possibile. STATI ECCITATI configurazione corrispondente ad energia più elevata. PRINCIPIO DI ESCLUSIONE DI PAULI: IN UN ATOMO NON PUÒ ESISTERE PIÙ DI UN ELETTRONE IN UNO STATO DEFINITO DA UNA DATA QUATERNA DI NUMERI QUANTICI. - 2e n, l, ml, ms 1. SE DUE ELETTRONI OCCUPANO UNO STESSO ORBITALE (n, l, ml sono uguali) I LORO SPIN DEVONO APPAIARSI. 2. NON CI POSSONO ESSERE PIÙ DI DUE ELETTRONI PER ORBITALE. 1s 2s 2p 3s 3p 3d CONFIGURAZIONE ELETTRONICA 4s 4p 4d 4f 5s 5p 5d 5f 6s 6p 6d 7s 7p Il Principio della Costruzione a Strati REGOLA DI HUND: ENTRO UN GRUPPO DI ORBITALI CON GLI STESSI VALORI DI n ED l, GLI ELETTRONI TENDONO A DISTRIBUIRSI IN ORBITALI DIVERSI CON SPIN PARALLELO. La Configurazione Elettronica degli Atomi La Configurazione Elettronica degli Ioni 3p 3p 3s 3s [Ne] [Ne] Na [Ne]3s1 Na+ [Ne] 4p 4p 4s 4s 4s 3d 3d 3d [Ar] [Ar] Fe 4p [Ar]3d64s2 [Ar] Fe2+ [Ar]3d6 Fe3+ [Ar]3d5 2p 2p 2s 2s [He] [He] O [He]2s22p4 O2- [He]2s22p6 Struttura Elettronica e Tavola Periodica 2 elettroni 8 elettroni 8 elettroni 18 elettroni 18 elettroni 32 elettroni Raggio Atomico e Raggio Ionico Def. Il RAGGIO ATOMICO di un elemento è la metà della distanza che separa i centri di due atomi contigui. Def. Il RAGGIO IONICO di un elemento è l’aliquota che gli spetta della distanza tra due ioni contigui in un solido ionico. ran + rcat 2r crescente Na+ Na Be2+ Be 100 pm decrescente O O2- F F- Energia di Ionizzazione Def. L’ENERGIA di IONIZZAZIONE è l’energia necessaria ad allontanare un elettrone da un atomo in fase gas. Primaria, I1: si parte dall’atomo neutro. Secondaria, I2: si parte dal catione a carica unitaria. Cu(g) Cu (g) e (g) crescente Cu (g) Cu2 (g) e (g) decrescente Affinità Elettronica Def. L’AFFINITÀ ELETTRONICA, Eae, è l’energia che si libera quando l’atomo in fase gas cattura un elettrone. Affinità Elettronica (kJ∙mol-1)
Scaricare