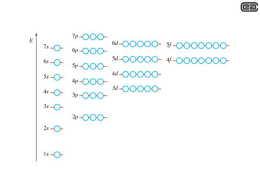
Descrivere la costruzione della configurazione elettronica di un atomo La configurazione elettronica indica il modo in cui gli elettroni occupano gli orbitali di uno specifico atomo. Per descrivere la configurazione elettronica, ogni orbitale viene rappresentato convenzionalmente con un quadratino all'interno del quale vanno inseriti gli elettroni i cui numeri quantici di spin sono rappresentati con frecce verticali rivolte verso l'alto o verso il basso. Gli orbitali di un atomo sono distinti da quattro numeri quantici: n, l, ml e ms e, per il principio di Pauli, non è possibile che due elettroni abbiano lo stesso valore per tutti e quattro i numeri. Il primo numero quantico n, detto numero quantico principale, determina la distanza media dal nucleo (dimensione dell'orbitale), che aumenta al crescere di n, e la maggior parte dell'energia dell'elettrone (livello energetico= periodo). Elettroni (e orbitali) che condividono n appartengono dunque allo stesso livello di energia, il numero quantico principale inoltre definisce l'energia dell'elettrone. Il numero quantico principale assume tutti i valori interi positivi in ordine crescente. Il secondo numero quantico l, detto numero quantico orbitale (o, più impropriamente, numero quantico secondario o azimutale o angolare o rotazionale), corrisponde al momento angolare dello stato. Questi stati prendono la forma di un'armonica sferica . Per ogni valore di n, il numero quantico orbitale assume in ordine crescente tutti i valori interi compresi tra 0 e n-1. I vari stati correlati ai differenti valori di l vengono a volte detti "sottolivelli" o "sottogusci" e vengono anche indicati da lettere, come elencato di seguito: Valore di l Lettera Massimo numero di elettroni nel sottolivello (pari a (2 × l + 1) × 2) 0 s 2 1 p 6 2 d 10 3 f 14 ... ... ... Il terzo numero quantico ml, detto numero quantico magnetico, che assume in ordine crescente tutti i valori interi compresi tra -l e l. Ogni stato distinto n-l-ml può essere occupato da due elettroni con spin opposto. Per scrivere la configurazione elettronica di un elemento ci sono tre regole da seguire: 1) Principio della costruzione progressiva: si occupano prima gli orbitali a più bassa energia e poi quelli a energia più elevata. Il contenuto energetico degli orbitali e quindi la sequenza di riempimento è rappresentata nello schema seguente (ogni orbitale è rappresentato da un quadratino): L'ordine di riempimento può essere ricordato seguendo la regola della diagonale: 2) Principio di esclusione di Pauli: ogni orbitale può contenere al massimo due elettroni, purché di spin opposto. In altre parole, all'interno di ogni orbitale (quadratino) possono essere inseriti al massimo due elettroni ma con spin opposto (e quindi verso delle frecce opposto) 3) Regole di Hund: quando si devono riempire gli orbitali aventi la stessa energia (degeneri) si colloca un elettrone su ciascun orbitale e poi si completano gli orbitali semipieni. Se ad esempio, dobbiamo inserire tre elettroni nei tre orbitali degeneri 2p, gli elettroni devono essere collocati nel seguente modo: Volendo invece inserire per esempio sette elettroni nei cinque orbitali degeneri 4d, dovremo scrivere: Applicando le tre regole appena viste, possiamo scrivere, a titolo di esempio, la configurazione elettronica dell'ossigeno, avete numero atomico Z = 8 La configurazione elettronica può essere rappresentata in modo sintetico, scrivendo gli elettroni ad esponente della sigla che identifica l'orbitale. Per l'ossigeno avremo: nella quale gli esponenti indicano il numero di elettroni che sono collocati in quel tipo di orbitale. Per scrivere la configurazione elettronica di un elemento, dapprima cerchiamo il numero atomico (Z) nella tavola periodica: questo numero corrisponde al numero di elettroni presenti nell’atomo neutro. Seguiamo poi l’ordine di riempimento degli orbitali per distribuire gli elettroni negli orbitali appropriati. Ricordiamo che ogni orbitale può ospitare un massimo di due elettroni, di conseguenza: -il sottolivello s possiede un solo orbitale e, pertanto, può contenere solo 2 elettroni. -il sottolivello p possiede tre orbitali e, pertanto, può contenere 6 elettroni. -il sottolivello d possiede cinque orbitali e, pertanto, può contenere 10 elettroni. -il sottolivello f possiede sette orbitali e, pertanto, può contenere 14 elettroni. In una configurazione elettronica è possibile individuare gli elettroni di valenza. Essi sono gli elettroni presenti nel suo ultimo livello di energia; sono quelli che partecipano alla formazione dei legami chimici e sono essi che determinano le proprietà chimiche di un elemento. Gli elettroni di valenza sono indicati nella tavola periodica dal numero romano posto all'apice della colonna su cui è collocato l'elemento (gruppo). Gli elettroni che si trovano nei livelli più interni sono chiamati elettroni interni: per esempio, nel silicio, che ha una configurazione elettronica 1s22s22p63s23p2, sono presenti 4 elettroni di valenza (quelli del livello principale n=3) e 10 elettroni interni. 1s22s22p6 3s23p2 Elettroni interni Elettroni di valenza Osservando la tavola periodica, notiamo che può essere divisa in blocchi che rappresentano il riempimento di particolari sottolivelli. -Le prime due colonne sulla sinistra sono dette blocco s: gli elementi di questo blocco possiedono una configurazione esterna ns1 (prima colonna) e ns2 (seconda colonna). -Le sei colonne alla destra sono dette blocco p. -I metalli di transizione costituiscono il blocco d. -I metalli e gli attinidi costituiscono il blocco f.
Scarica