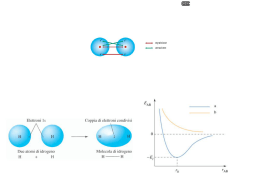
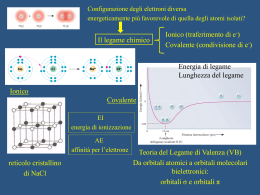
Il legame chimico Configurazione degli elettroni diversa ed energeticamente più favorevole di quella degli atomi isolati? Ionico (traferimento di e-) legame chimico Covalente (condivisione di e-) legame ionico e- EI bassa AE elevata Attrazione elettrostatica Legame ionico Na( g ) Na(g ) e Cl( g ) e Cl(g ) Na(g ) Cl(g ) Na( g ) Cl( g ) EI 494,0 kj mol 1 AE 368,0 kj mol 1 ( Na Cl )( g ) ( Na Cl )( g ) Ecoul 584,0 kj mol 1 458,0 kj mol 1 E reticolare! MA Na( s ) Na( g ) Na( g ) Na(g ) e EI 1 Eatom Cl2( g ) Cl( g ) 2 Cl( g ) e Cl(g ) AE Na(g ) Cl(g ) 108,8 kj mol 1 E sub 494,0 kj mol 1 119,7 kj mol 1 368,0 kj mol 1 ( Na Cl )( s ) Eret 786,6 kj mol 1 1 Na( s ) Cl2( g ) 2 ( Na Cl )( s ) 432,1 kj mol 1 Legame covalente Energia di legame Lunghezza del legame Modello di Lewis Guscio di valenza: pieno non pieno → → stabilità reattività Regola dell’ottetto: 4 coppie di e- condivise e/o solitarie = STABILITA’ EI ed AE molto diversi: EI ed AE simili: trasferimento elettronico → legame ionico condivisione di elettroni → legame covalente MA eccezioni alla regola dell’ottetto: molecole con numero dispari di e- ? es. NO molecole con carenza di e ? es. BF3 molecole con espansione del guscio di valenza ? es. SF6 Dagli orbitali atomici agli orbitali molecolari Descriviamo il modello classico del legame covalente, basato sulla condivisione degli elettroni, con la Meccanica Quantistica Teoria del legame di valenza (VB) Teoria degli orbitali molecolari (MO) descrive la coppia di elettroni condivisa e localizzata tra due nuclei impegnati nel legame con un orbitale molecolare bielettronico descrive tutti gli elettroni di una molecola distribuiti su orbitali molecolari e delocalizzati su tutta la molecola Geometrie HA : HB con ψA1 e ψB2 Ψcov = ψA1ψB2 + ψA2ψB1 + ψA1 ψA2 + ψB1ψB2 covalente ionico Legami multipli coniugati Reattività di specie radicaliche Paramagnetismo Legame metallico Ricordiamo che stiamo descrivendo la particella «elettrone» in termini ondulatori la sovrapposizione di due orbitali dà luogo a interferenze Sovrapposizione frontale: orbitali molecolari σ simmetria cilindrica rispetto all’asse internucleare max densità lungo l’asse internucleare Legame σ Sovrapposizione Laterale: orbitali molecolari π max sovrapposizione possibile legame fortemente direzionale 1° legame tra due nuclei energia di legame NO simmetria cilindrica max densità ai lati dell’asse internucleare Legame π legame successivo al 1° energia di legame minore MA rafforza e «blocca» il legame σ HCl Cl2 σ π π N2 permesse proibite Molecole poliatomiche La teoria del VB descrive ogni legame singolarmente: le coppie di elettroni condivise sono “localizzate” tra i due nuclei interessati al legame COME SONO FATTE LE MOLECOLE? coppie di elettroni = zone ad elevata densità elettronica Forti repulsioni Geometrie compatibili con il contenuto energetico più favorevole Metodo VSEPR (Valence Shell Electron Pair Repulsion) - Scelta atomo meno elettronegativo come atomo centrale - Disporre i suoi elettroni del guscio di valenza spaiati e a spin parallelo - Accoppiare gli e- (di legame bp o coppie solitarie lp) - Contare le coppie di e- (σ-bp + lp) - Assegnare la geometria - Distorsione delle geometrie: lp-lp > lp-bp > bp-bp Geometrie molecolari acqua ammoniaca Distorsione delle geometrie Distorsione delle geometrie
Scaricare