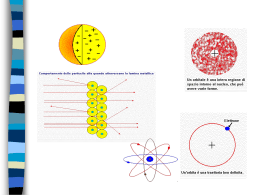
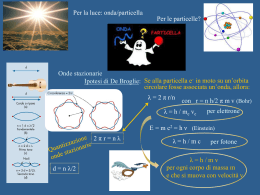
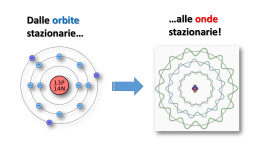
LE PARTICELLE ELEMENTARI: loro scoperta Atomo: composto da particelle elementari più piccole (protoni, neutroni, elettroni) Atomi di elementi diversi contengono le STESSE particelle, ma in numero diverso Natura e comportamento degli elettroni: dimostrata con studi sulla scarica di gas STRUTTURA DELL'ATOMO Vari esperimenti condotti all'inizio del 1900 dimostrarono che gli atomi non sono indivisibili ma costituiti da particelle più piccole (elementari). Elettrone Se a due elettrodi posti alle estremità di un tubo in cui è fatto il vuoto viene applicato un alto voltaggio, dall'elettrodo negativo (catodo) si dipartono dei raggi detti raggi catodici. Thomson dimostrò che tali raggi sono costituiti da un flusso di particelle cariche negativamente che chiamò elettroni. Tubo a raggi catodici La deviazione di un raggio catodico da parte di un campo elettrico e di un campo magnetico ESPERIMENTO DI THOMSON Misura del rapporto carica/massa dell'elettrone: un fascio di raggi catodici attraversa un campo elettrico e un campo magnetico. L'esperimento è predisposto in modo che il campo elettrico devii il fascio in una direzione mentre il campo magnetico lo devia nella direzione opposta. Bilanciando gli effetti è possibile determinare il rapporto carica/massa dell'elettrone. e/m=1,7588 1011 C/Kg Quantizzazione della carica elettrica: esperimento di Millikan Gocce di olio cariche elettricamente vengono fatte cadere in presenza di un campo elettrico. Dalla massa nota delle goccioline e dal voltaggio applicato per mantenere ferme le gocce cariche si potè calcolare la carica presente sulle gocce. Fu trovato che tutte le cariche elettriche sono multiple di una carica elementare minima e assunta come carica dell'elettrone. e=1,602 10-19 C (coulomb) Thomson aveva calcolato: e/m= 1,76 1011 C/Kg da cui si dedusse: m= 9,1110-31 Kg Un valore circa 1800 volte più piccolo della massa dell'idrogeno. PRIMO MODELLO ATOMICO: THOMSON Sfera uniforme di cariche positive in cui sono distribuiti gli e- in maniera casuale e uniforme Esperimento di Rutherford: invalidazione del modello di Thomson Particelle a : nuclei di He, molto pesanti, privi dei 2 e- (2 cariche +) bombardanti una sottile lamina di oro Schermo rivelatore Osservazione: Alcune passavano indisturbate (A) Alcune leggermente deflesse (B) Conclusione: Atomo costituito da un nucleo (+) in cui è concentrata la massa e da e- (-) all’esterno del nucleo Alcune rimbalzate indietro (C) 1. Particella a (più pesante dell’e-!) collidente con gli e-: NO deviazione traiettoria 2. Particella a passante vicino al nucleo: deviazione traiettoria di angoli variabili 3. Particella a collidendo con il nucleo: repulsione “Fu il fatto più incredibile che mi fosse capitato…Era così incredibile come se sparando un proiettile di 15 pollici su un foglio di carta esso tornasse indietro e vi colpisse…” IL MODELLO ATOMICO DI RUTHERFORD (1911) La carica positiva e quasi tutta la massa sono racchiuse nel nucleo centrale Gli elettroni ruotano intorno al nucleo come i pianeti intorno al Sole Il nucleo è piccolissimo (10-15m) in confronto al resto dell’atomo (10-10m) L’atomo è praticamente vuoto + I PROBLEMI DEL MODELLO PLANETARIO F v Secondo Rutherford l’elettrone si muoverebbe sulla sua orbita in equilibrio tra la forza elettrica di attrazione del nucleo e la forza centrifuga derivante dalla sua velocità Una particella elettrica in movimento perde energia sotto forma di radiazioni elettromagnetiche L’elettrone che perde energia si avvicina sempre di più al nucleo fino a caderci sopra Nella realtà ciò non avviene Il modello di Rutherford non giustifica quindi la stabilità dell’atomo LE ONDE Lunghezza d’onda λ Ampiezza A λ λ λ periodo T: intervallo di tempo in cui l’onda compie un’oscillazione completa frequenza n : numero di oscillazioni complete che l’onda compie in una secondo. L’unità di misura della frequenza è lo Hertz (Hz) 1Hz = 1 ciclo al secondo Frequenza e periodo sono l’uno l’inverso dell’altra, quindi: n=1/T T=1/n velocità spazio tempo per un’onda velocità (v) λ T quindi v = λn ONDE MECCANICHE: hanno bisogno di un mezzo per propagarsi Le particelle del mezzo vibrano, oscillando intorno alla posizione di equilibrio Suono Onde del mare Terremoto ONDE ELETTROMAGNETICHE: non hanno bisogno di un mezzo per propagarsi (si propagano anche nel vuoto) Un campo elettrico ed uno magnetico oscillano (variano) nello spazio in modo perpendicolare tra loro Hanno tutte la stessa velocità c = 3• 108 m/s (velocità della luce) Da ciò deriva che, essendo c = λn, per tutte le onde elettromagnetiche frequenza e lunghezza d’onda sono tra loro inversamente proporzionali. Interazioni radiazione elettromagnetica-materia: fondamentali per conoscere la struttura degli atomi e delle molecole Radiazione elettromagnetica: ONDA che si propaga alla velocità della luce Caratteristiche di un’onda: (lunghezza d’onda): distanza fra due massimi o minimi n (frequenza): n° di onde che passano in un punto in 1 secondo A(ampiezza): Altezza del max, indicativa dell’intensità n = f (; v) v: velocità di propagazione dell’onda se v = c : LUCE n=v/ L’insieme delle radiazioni elettromagnetiche a diverse costituisce lo spettro elettromagnetico (Raggi cosmici-Onde elettriche) Luce visibile: parte dello spettro percepibile con l’occhio umano SPETTROSCOPIA Intorno alla metà dell’800 Kirchoff inizia l’analisi spettroscopica Gas e vapori riscaldati producono spettri di emissione a righe Gustav Kirchoff (1824 – 1884) Gas e vapori freddi producono spettri di assorbimento a righe Gli spettri di emissione e di assorbimento sono complementari Le righe hanno una posizione (e quindi una lunghezza d’onda) caratteristica della sostanza L’emissione di luce è prodotta dal movimento eccitatorio degli elettroni provocato dal calore La fisica dell’800 non è capace di spiegare gli spettri a righe LA TEORIA QUANTISTICA Nel 1900 Max Planck propone la quantizzazione dell’energia L’energia non si trasferisce in modo continuo, ma per quantità discrete, dette quanti Max Planck (1857 – 1947) Per le onde elettromagnetiche l’energia dei vari quanti dipende dalla lunghezza d’onda della radiazione associata Legge di Planck E = hn MAX PLANCK (1900) : Teoria sulla quantizzazione dell’Energia L’Energia, come la materia, non puo’ essere suddivisa all’infinito, ma fino a una certa quantità minima: il QUANTO QUANTO: La più piccola porzione che puo’ essere ottenuta dal processo di suddivisione dell’Energia. In tutti i processi fisici l’Energia puo’ essere emessa o assorbita solo in QUANTI o multipli di essi E=hn h = costante di Planck 0.66 x 10-33 J/s Planck era tuttavia un fisico teorico e non approfondì quindi le possibili applicazioni della sua rivoluzionaria teoria Nel 1905 Einstein utilizza la teoria quantistica per spiegare l’effetto fotoelettrico A qualsiasi onda luminosa è associabile un quanto, la cui energia dipende dalla frequenza, secondo la legge di Planck E = hn Albert Einstein (1879 – 1955) Un quanto di sufficiente energia, che colpisce un elettrone del metallo, lo mette in movimento come avviene in un urto tra le palle di un biliardo Un’onda elettromagnetica può essere in certi casi pensata come una particella, cui viene dato il nome di fotone La luce ha quindi una doppia natura: ondulatoria e corpuscolare DUALISMO ONDA-PARTICELLA E = mc2 Equazione di Einstein Massa del fotone E = hn Legge di Planck hn m 2 c mc2 = hn Frequenza dell’onda elettromagnetica IL MODELLO ATOMICO DI BOHR (1913) L’elettrone non può stare a distanza qualsiasi dal nucleo, perché ruota intorno ad esso solo su orbite circolari determinate Il raggio delle orbite può assumere solo valori fissati, definiti da n (numero quantico principale, che assume solo valori interi) Maggiore è n, tanto più lontani dal nucleo ruotano gli Nils Bohr (1885 – 1962) elettroni e tanto più alta è la loro energia Quando l’elettrone percorre una di queste orbite, dette orbite stazionarie, non emette, né assorbe energia: ecco perché non può cadere sul nucleo, come conseguiva invece dal modello di Rutherford L’elettrone assorbe o emette energia solo quando salta da un’orbita all’altra (salto quantico) Gli elettroni di ogni elemento scambiano solo l’energia esattamente necessaria per passare da una all’altra delle proprie orbite Salto quantico (caratteristico di ogni elemento) Energia (solo quella necessaria) Frequenza E = hn Gli spettri di emissione e di assorbimento sono complementari L’energia dell’elettrone è quantizzata Colori degli spettri Bohr dimostrò che non era possibile ricostruire la struttura dell’atomo utilizzando solo la fisica classica, ma che era necessario ricorrere alla teoria quantistica Tuttavia il suo modello atomico valeva solo per il più semplice degli atomi (quello di idrogeno), mentre non era più capace di spiegare gli spettri degli appena più complessi L’ELETTRONE: PARTICELLA O ONDA? Nel 1924 il fisico francese de Broglie, ribaltando la tesi di Einstein, sostiene che, se un’onda luminosa corrisponde ad una particella (fotone), allora anche una particella (elettrone) corrisponde ad un’onda elettromagnetica Lunghezza dell’onda L. de Broglie (1892 – 1987) h λ cm Massa dell’elettrone L’onda è stazionaria, ovvero oscilla in modo costante, coprendo le orbite circolari di Bohr con un numero intero di lunghezze d’onda Ciò tuttavia non risolve i limiti del modello di Bohr ed anzi introduce nuovi problemi: come stabilire la posizione dell’elettrone-onda? Bohr aveva fatto un primo passo in avanti, sostenendo la quantizzazione dell’energia dell’elettrone; tuttavia continuava a immaginare il suo moto regolare e prevedibile, come quello dei pianeti intorno al Sole. La realtà dell’atomo richiedeva invece passi ulteriori verso una nuova fisica. Nel mondo macroscopico, ad esempio, non abbiamo problemi nel calcolare contemporaneamente sia la velocità (e quindi l’energia), che la posizione di un qualsiasi corpo. IL PRINCIPIO DI INDETERMINAZIONE (1927) Non è possibile conoscere, in modo esatto, sia la posizione che l’energia posseduta da un elettrone Se si misura con molta precisione una delle due grandezze, allora si commette un grosso errore nella misurazione dell’altra W. Heisemberg (1901 – 1976) h Dx Dp ≥ 4 Dx: errore sulla posizione Dp (p=mv): errore sulla velocità Ciò accade perché misurando si interferisce con la grandezza del sistema che vogliamo misurare Questo porta al definitivo superamento della concezione meccanicista dell’atomo, ove l’elettrone percorre traiettorie fisse con moto regolare. L’ORBITALE (1926) Il fisico austriaco Erwin Schrödinger, basandosi sugli studi di de Broglie, elabora una funzione matematica (Y) con cui si può calcolare la probabilità di trovare un elettrone di energia nota in una certa regione di spazio intorno al nucleo Dal modello deterministico, ove si riteneva possibile conoscere con dettaglio il moto dell’elettrone in ogni momento, in base alla conoscenza delle forze fisiche che lo E. Schrödinger (1887 – 1961) determinano, ad un modello probabilistico, basato sulla probabilità di trovare l’elettrone in un dato volume di spazio intorno al nucleo I lavori di Schrödinger ed Heisemberg, segnano il definitivo superamento della meccanica classica riguarda la descrizione del mondo atomico. La nuova fisica che prenderà il suo posto, verrà chiamata meccanica quantistica. Il moto dell’elettrone è incessante e casuale e disegna intorno al nucleo una nube di densità elettronica, ove l’intensità del colore segna la probabilità di incontrare l’elettrone Orbitale: regione di spazio nella quale un certo elettrone trascorre il 90% del proprio tempo Le caratteristiche degli orbitali sono definite da tre numeri, chiamati numeri quantici Numero quantico principale n 1° livello 2° livello Può assumere tutti i valori interi compresi tra 1 e 7 Da indicazioni sulle dimensioni e l’energia degli orbitali Gli orbitali sono raccolti in livelli energetici nucleo 3° livello Numero quantico secondario l Varia al variare di n, assumendo tutti i valori interi compresi tra 0 e n -1 Da indicazioni sulla forma degli orbitali l = 0 orbitali sferici (s) l = 1 orbitali a farfalla (p) Orbitale s l = 2 orbitali di forma complessa (d) l = 3 orbitali di forma complessa (f) Orbitale p Numero quantico magnetico m Varia al variare di l, assumendo tutti i valori interi compresi tra – l…0 e…+l Da indicazioni sull’orientamento ed il numero degli orbitali di una data forma (per ogni orientamento deve esserci un orbitale) Numero quantico di spin ms Assume solo due valori: + ½ e – ½ E’ riferito all’elettrone, non agli orbitali, ed indica il suo senso di rotazione su se stesso. Principio di esclusione di Pauli In ogni orbitale possono stare al massimo due elettroni che debbono avere spin opposto W. Pauli Quadro riassuntivo sui numeri quantici Simbolo Valori Principale n 1…..7 Angolare l 0….n-1 Magnetico m - l…0…+l Orientamento e numero degli orbitali Spin ms + ½; – ½ Nome Significato Dimensioni ed energia dell’orbitale Forma dell’orbitale Senso di rotazione dell’elettrone 1° livello energetico n = 1 l=0 n=1 Livello energetico 1S2 Numero di elettroni presenti nell’orbitale Tipo di orbitale m=0 Un orbitale sferico FUNZIONE DISTRIBUZIONE DI PROBABILITA’ Per l’orbitale 1s la probabilità di trovare l’e- è massima sul nucleo e decresce asintoticamente man mano che ci si allontana da esso 2° livello energetico n = 2 l=0 n=2 m=0 Un orbitale sferico m = -1 l=1 m=0 12 2S Tre orbitali a farfalla m=1 2p6 Regola di Hund Avendo a disposizione orbitali con la stessa energia, di cui qualcuno semiriempito e qualcuno vuoto, un elettrone va ad occupare uno di quelli vuoti, disponendosi con spin parallelo a quello dell’elettrone o degli elettroni già presenti 3° livello energetico n = 3 l=0 m=0 Un orbitale sferico 2 3S m = -1 l=1 m=0 Tre orbitali a farfalla 3p6 m=1 n=3 m = -2 m = -1 l=2 m=0 m=1 m=2 cinque orbitali d 3d10 4° livello energetico n=4 l=0 m=0 m = -1 m=0 m=1 l=1 l=2 n=4 l=3 m = -3 m = -2 m = -1 m=0 m=1 m=2 m=3 Un orbitale sferico Tre orbitali a farfalla m = -2 cinque orbitali d m = -1 m=0 m=1 m=2 sette orbitali f 4f14 2 4S 4p6 4d10 l=1; m=-1; 0; +1 3 possibili orientazioni Orbitali p (px, py, pz) l=3 m = -2; -1; 0; +1; +2 5 orbilati di tipo d Quadro riassuntivo sui livelli energetici e sugli orbitali Livello energetico Primo Secondo Terzo Quarto n l m Tipo N° nome 1 0 0 S 1 1S 0 0 S 1 2S 1 -1,0,+1 p 3 2p 0 0 S 1 3S 1 -2,-1,0,+1,2 p 3 3p 2 -1,0,+1 d 5 3d 0 0 S 1 4S 1 -1,0,+1 p 3 4p 2 -2,-1,0,+1,2 d 5 4d 3 -3,-2,-1,0,+1,2,3 f 7 4f 2 3 4 IL RIEMPIMENTO DEGLI ORBITALI Inizia dagli orbitali più vicini al nucleo, che sono anche quelli con minore energia Deve rispettare il principio di Pauli e la regola di Hund Entro uno stesso livello energetico si riempiono prima gli orbitali con l minore Tuttavia da un certo punto in poi le cose si complicano…… 1s, 2s, 2p, 3s, 3p, 4s, 3d; 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d LA CONFIGURAZIONE ELETTRONICA ovvero il modo in cui gli elettroni si dispongono negli orbitali Ogni atomo si caratterizza per il proprio numero atomico Z (numero dei protoni e degli elettroni) La configurazione elettronica di un atomo si ottiene facendone il riempimento col numero di elettroni che gli competono in base al numero atomico Configurazione elettronica esterna: configurazione dell’ultimo livello energetico (il più esterno) Configurazione elettronica interna: configurazione dei livelli energetici che stanno sotto all’ultimo livello (più all’interno di questo) La configurazione elettronica esterna è molto più importante di quella interna, perché gli atomi interagiscono tra di loro solo attraverso gli elettroni più esterni Dalla configurazione elettronica esterna di un atomo dipende il suo comportamento chimico: con chi reagisce, come reagisce, quali composti forma CONFIGURAZIONE ELETTRONICA Costruzione degli atomi e loro struttura elettronica: AUFBAU Regole da tener presente: 1. Gli elettroni tendono sempre a occupare orbitali disponibili in ordine di energia crescente 2. Un orbitale non puo’ essere occupato da più di 2 elettroni 3. Due elettroni nello stesso orbitale devono avere spin opposto (Principio di esclusione di Pauli) 4. Gli elettroni tendono ad occupare il n° massimo di orbitali disponibili con uguale energia Nome Simbolo Z Configurazione elettronica 1° livello energetico Idrogeno H 1 1S1 Elio He 2 1S2 2° livello energetico Litio Li 3 1S2 2S1 Berillio Be 4 1S2 2S2 Boro B 5 1S2 2S2 2p1 Carbonio C 6 1S2 2S2 2p2 Azoto N 7 1S2 2S2 2p3 Ossigeno O 8 1S2 2S2 2p4 Fluoro F 9 1S2 2S2 2p5 Neon Ne 10 1S2 2S2 2p6
Scaricare