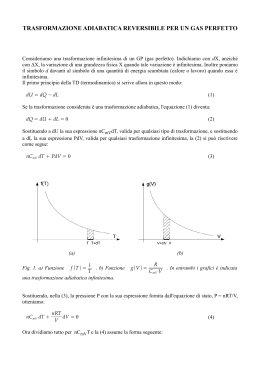
Esercizio n.21 di pagina 98. m = 90 g tA = 10 °C tB = 100 °C pa = 1.013105 Pa massa di azoto N2 (gas biatomico) temperatura iniziale nello stato termodinamico A temperatura finale nello stato termodinamico B pressione atmosferica (costante) calcoliamo dapprima le temperature assolute: Determiniamo la variazione di energia interna U e il lavoro L con le seguenti relazioni: (si noti il valore 5 invece del valore 3 tipico dei gas monoatomici) Per entrambe è necessario determinare il numero di moli partendo dalla massa e dalla massa molecolare Otteniamo quindi: Per il calcolo di Q ricorriamo all’equazione della prima legge della termodinamica: Per esercizio si può determinare Q applicando l’equazione fondamentale della calorimetria espressa in funzione del numero di moli e del calore specifico molare a pressione costante: Esercizio n.23 di pagina 98. n = 2 moli = 1.40 L=? U = ? Q=? quantità di gas ideale (espressa in moli) sottoposta al processo ABC rapporto tra Cp e Cv del gas lavoro totale compiuto durante il processo variazione di energia interna calore totale scambiato durante il processo Le due trasformazioni cui è sottoposto il gas A Y B e B Y C non sono catalogabili tra quelle tipiche (isocora; isobara; isotermica; adiabatica) per cui non possiamo utilizzare nessuna delle relazioni conosciute; possiamo però considerare che il lavoro compiuto o subito dal sistema durante una trasformazione termodinamica è uguale all'area sottesa al cammino della trasformazione nel diagramma P-V (piano di Clapeyron). L'area sottesa ai segmenti AB e BC è scomponibile in un triangolo e un rettangolo, per cui si ha: La variazione di energia interna complessiva dipende solo dalle temperature nello stato finale C e nello stato iniziale A. K è ricavabile dall'espressione poiché = 1.4 ricaviamo K= 5. (cfr. pag.77 del libro di testo) La variazione di temperatura si determina scrivendo l'equazione di stato dei gas perfetti per lo stato A e per lo stato C, sottraendo membro a membro quella in C da quella in A, ed ottenendo: Sostituendo quest'ultima nella (1) si ha Per il calcolo di Q ricorriamo all’equazione della prima legge della termodinamica: Relativamente al segno, L, U e Q sono tutti e tre positivi. Il lavoro, in una trasformazione in cui vi è aumento di volume, è positivo (si noti il verso di percorrenza della serie di trasformazioni). La variazione di energia interna è positiva in quanto vi è un aumento di temperatura. Esercizio n.26 di pagina 98. V0 = 16000 cm3 n = 1.1 moli t0 = 30 °C V1 = 1600 cm3 t1 = ? L=? volume occupato dal gas prima della compressione quantità di gas CO2 sottoposta a compressione adiabatica temperatura iniziale del gas volume occupato dal gas dopo la compressione temperatura del gas dopo la compressione lavoro compiuto sul gas In una trasformazione adiabatica si hanno le seguenti relazioni tra pressione e volume e tra temperatura assoluta e volume: Dalla (2) determiniamo T1 dopo aver calcolato T0 in kelvin: In cui = 1.3 (tabella 3.1 pagina 77) Dalla relazione della prima legge della termodinamica, considerando che non vi è scambio di calore con l'ambiente essendo la trasformazione adiabatica, la quantità di calore è zero: Considerando che il gas è poliatomico K assume il valore 7, e quindi:
Scaricare