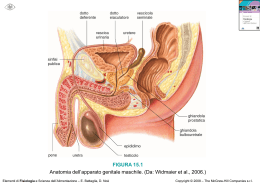
Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl CAPITOLO 5 I GAS 5.13 5.14 Strategia: poiché 1 atm = 760 mmHg, è necessario il seguente fattore di conversione per ottenere la pressione in atmosfere. Per la seconda conversione, 1 atm = 101.325 kPa. Soluzione: 5.17 (a) Se la temperatura finale del campione è al di sopra del punto di ebollizione, sarà ancora nella fase gassosa. Il diagramma che rappresenta meglio la situazione è (d). (b) Se la temperatura del campione è inferiore al punto di ebollizione, condenserà a liquido. Il liquido avrà una tensione di vapore, così un po’ del campione resterà nella fase gassosa. Il diagramma che meglio rappresenta la situazione è (b). 5.18 (1) Ricorda che V ∝ 1/P. Se la pressione è triplicata, il volume diminuirà di 1/3 rispetto al volume iniziale, assumendo che n e T siano costanti. La scelta corretta è (b). (2) Ricorda che V ∝ T. Se la temperatura raddoppia, anche il volume raddoppierà, assumendo che n e P siano costanti. La scelta corretta è (a). L’intensità del colore indica la densità del gas. Se il volume aumenta tenendo costanti le moli del gas, la densità del gas diminuirà. Questa diminuzione della densità del gas è indicata dalla minore intensità del colore. (3) Ricorda che V ∝ n. Partendo da n moli di gas, aggiungendo altre n moli di gas (2n totali) il volume raddoppierà. La scelta corretta è (c). La densità del gas resterà la stessa quando le moli e il volume saranno raddoppiati. Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl (4) Ricorda che V ∝ T e V ∝ 1/P. Dimezzando la temperatura il volume diminuirà di ½ rispetto al suo valore iniziale. Tuttavia, riducendo la pressione di ¼ del suo valore iniziale, il volume aumenterà di un fattore 4. Combinando i due cambiamenti, abbiamo Il volume raddoppierà. La scelta corretta è (a). 5.19 5.20 La temperatura e la quantità di gas non aumentano in questo problema (T1 = T2 e n1 = n2). La pressione e il volume cambiano; ciò ha a che vedere con la legge di Boyle. Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl 5.21 5.22 (a) Strategia: la quantità di gas e la sua temperatura restano costanti, ma sia la pressione che il volume cambiano. Quale equazione userai per calcolare il volume finale? Soluzione: Partiamo con l’Equazione (5.9) del testo. Poiché n1 = n2 e T1 = T2 che è la legge di Boyle. L’informazione data è riassunta di seguito Condizioni iniziali Condizioni finali Il volume finale è dato da: Verifica: quando la pressione applicata al campione d’aria è aumentata da 1.2 atm a 6.6 atm, il volume occupato dal campione diminuirà. La pressione e il volume sono inversamente proporzionali. Il volume finale calcolato è minore del volume iniziale, così la risposta sembra ragionevole. Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl (b) Strategia: La quantità di gas e la sua temperatura restano costanti, ma sia la pressione che il volume cambiano. Quale equazione userai per calcolare la pressione finale? Soluzione: Anche in questo caso dovresti usare l’equazione P1V1 = P2V2. L’informazione data è riportata di seguito. Condizioni iniziali Condizioni finali La pressione finale è data da: Verifica: per diminuire drasticamente il volume del gas da 3.8 L a 0.075 L, la pressione deve essere consistentemente aumentata. Una pressione finale di 61 atm sembra ragionevole. 5.23 5.24 Strategia: la quantità di gas e la sua pressione restano costanti, ma cambiano la temperatura e il volume. Quale equazione userai per calcolare la temperatura finale? Quale unità di misura userai per la temperatura? Soluzione: partiamo con l’Equazione (5.9) del testo. Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl Poiché n1=n2 e P1=P2 che è la legga di Charles. L’informazione data è classificata come segue Condizioni iniziali Condizioni finali La temperatura finale è data da 5.25 La reazione bilanciata è: Ricorda che la legge di Avogadro dice che il volume di un gas è direttamente proporzionale al numero di moli del gas a temperatura e pressione costanti. Nella reazione bilanciata i coefficienti dell’ammoniaca e dell’ossido nitrico sono gli stessi, così si ottiene un volume di ossido nitrico da un volume di ammoniaca. Potresti arrivare alla stessa conclusione se sapessi che l’ossido nitrico è il solo prodotto che contiene azoto e che l’ammoniaca è il solo reagente che contiene azoto? 5.26 Questo è un problema stechiometrico sui gas che, per essere risolto, richiede la conoscenza della legge di Avogadro. Tale legge dice che il volume di un gas è direttamente proporzionale al numero di moli del gas a temperatura e pressione costante. Il rapporto in volume, 1 vol. di Cl2 : 3 vol. di F2 : 2 vol. di prodotto, può essere scritto come rapporto molare, 1 mol di Cl2 : 3 mol di F2 : 2 mol di prodotto. Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl Proviamo a scrivere una reazione chimica bilanciata. Il pedice di F nel prodotto sarà tre volte quello di Cl, perché per ogni atomo di cloro reagiscono tre atomi di fluoro. Bilanciamo l’equazione. La x deve essere pari a uno in modo da avere due atomi di Cl su ogni lato dell’equazione. Se x = 1, il pedice di F è 3. La formula del prodotto è ClF3. 5.31 5.32 Strategia: questo problema fornisce la quantità, il volume e la temperatura di CO2 gassoso. Cambiano le proprietà del gas? Quale equazione useremo per calcolare la pressione? Quale unità di misura sarà usata per la temperatura? Soluzione: poiché non avvengono variazioni delle proprietà dei gas, possiamo usare l’equazione dei gas ideali per calcolare la pressione. Risistemando l’Equazione (5.8) del testo, scriviamo: 5.33 Risolviamo l’equazione dei gas ideali per V 5.34 In questo problema, le moli e il volume occupato dal gas sono costanti (V1 = V2 e n1 = n2). La temperatura e la pressione cambiano Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl l’informazione data è schematizzata come segue. Condizioni iniziali Condizioni finali La temperatura finale è data da 5.35 Condizioni iniziali Condizioni finali 5.36 In questo problema, le moli e il volume occupato dal gas sono costanti (V1 = V2 e n1 = n2). Cambiano la pressione e la temperatura. Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl L’informazione data è schematizzata di seguito. Condizioni iniziali Condizioni finali La pressione finale è data da 5.37 Nota che l’affermazione “….la sua temperatura assoluta è dimezzata” implica che T2/T1 = 0.50. Allo stesso modo, l’affermazione “…la pressione è diminuita di un terzo rispetto alla pressione originaria” indica che P2/P1 = 1/3. 5.38 In questo problema, le moli e la pressione del gas sono costanti (n1 = n2 e P1 = P2). La temperatura e il volume subiscono variazioni. L’informazione data è schematizzata come segue: Condizioni iniziali Condizioni finali Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl Il volume finale è dato da 5.39 5.40 In questo problema, il numero di moli del gas è costante. Cambiano la pressione, il volume e la temperatura. Nota: Poiché R non è presente in quest’equazione, le unità di misura della pressione e della temperatura non devono essere espresse in atm e litri, rispettivamente. Tuttavia, la temperatura deve essere sempre espressa in Kelvin per i calcoli con la legge dei gas. Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl 5.41 5.42 La massa molare di CO2 = 44.01 g/mol. Poiché PV = nRT, scriviamo: 5.43 Calcoliamo il numero di moli del gas usando l’equazione dei gas ideali. Calcoliamo la massa molare: 5.44 Strategia: possiamo calcolare la massa molare del gas se conosciamo la sua densità, temperatura e pressione. Quali unità di misura useremo per la temperatura e per la pressione? Soluzione: abbiamo bisogno di usare l’Equazione (5.12) del testo per calcolare la massa molare del gas. Prima di sostituire nella sovrastante equazione, dobbiamo calcolare la densità e verificare che le altre quantità note (P e T) abbiano le unità di misura appropriate. Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl Calcoliamo la massa molare sostituendo le quantità note In alternativa, possiamo calcolare la massa molare scrivendo: massa molare del composto = massa del composto moli del composto La massa del composto è data nel problema (7.10 g), così abbiamo bisogno di calcolare le moli del composto per poter calcolare la massa molare. Ora, possiamo calcolare la massa molare del gas massa molare del composto = massa del composto moli del composto = Usando i due metodi di calcolo diversi, si osserva una lieve differenza nelle risposte, 35.0 g/mol paragonato a 35.1 g/mol. Questo è dovuto all’arrotondamento della densità a 1.31 g/mL nel primo Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl calcolo. Se prendiamo un maggior numero di cifre significative per la densità (1.3148 g/mL), si otterrà una massa molare di 35.1 g/mol anche dal primo metodo. 5.45 Per primo calcoliamo le moli di ozono (O3) usando l’equazione dei gas ideali Usiamo il numero di Avogadro come fattore di conversione per convertire a molecole di O3. 5.46 Il numero di particelle in 1 L di gas in c.n. è: 5.47 La densità è data da: Calcolando la massa molare: Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl 5.48 La densità può essere calcolata dall’equazione dei gas ideali. In alternativa, possiamo calcolare la densità scrivendo: densità = massa volume Assumendo di avere 1 mole di HBr, la massa è 80.91 g. Il volume del gas può essere calcolato usando l’equazione dei gas ideali. Ora, possiamo calcolare la densità di HBr gassoso Usando i due metodi di calcolo diversi, c’è una lieve differenza nei risultati, 2.98 g/L paragonato a 2.97 g/L. Questo è dovuto all’arrotondamento del volume a 27.2 L nel secondo calcolo. Se prendiamo un maggior numero di cifre significative per il volume (27.17 L), si otterrà una densità di 2.98 g/L anche con il secondo metodo. Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl 5.49 METODO 1: La formula empirica può essere calcolata dai dati di massa percentuale. La massa molare può essere calcolata usando l’equazione dei gas ideali. Si può determinare la formula molecolare. Per calcolare la formula empirica, assumiamo 100 g di sostanza. Questo dà la formula C5.40H13.4O1.35. Dividendo per 1.35 abbiamo la formula empirica C4H10O. Per calcolare la massa molare, calcoliamo per prima il numero di moli del gas usando l’equazione dei gas ideali. Calcolando la massa molare: La massa empirica è 74.0 g/mol che è essenzialmente la stessa della massa molare. In questo caso, la formula molecolare è uguale alla formula empirica. C4H10O. METODO 2: Per prima cosa calcoliamo la massa molare usando l’equazione dei gas ideali Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl Calcolando la massa molare: Poi moltiplichiamo la massa percentuale (convertita in decimale) di ogni elemento per la massa molare per ottenere i grammi di ogni elemento. Quindi, usiamo la massa molare per ottenere le moli di ogni elemento. Poiché abbiamo usato la massa molare per calcolare le moli di ogni elemento presente nel composto, questo metodo dà direttamente la formula molecolare, che è C4H10O. 5.50 Questa è un’estensione dei calcoli con la legge dei gas ideali che richiede la massa molare. Se determini la massa molare del gas, sarai capace di determinare la formula molecolare dalla formula empirica. Calcoliamo la densità, quindi sostituiamo il suo valore nell’equazione sovrastante Paragoniamo la massa empirica alla massa molare. Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl Ricordiamo che la massa molare sarà un multiplo intero della massa empirica. In questo caso, la massa molare/massa empirica ≈ 1. Quindi, la formula molecolare è uguale alla formula empirica, SF4. 5.51 Dalle moli di CO2 prodotte, possiamo calcolare la quantità di carbonato di calcio che deve aver reagito. Possiamo poi determinare la percentuale in peso di CaCO3 in 3.00 g di campione. La reazione bilanciata è: Le moli di CO2 prodotte possono essere calcolate usando l’equazione dei gas ideali La reazione bilanciata mostra un rapporto di moli di 1 : 1 tra CO2 e CaCO3. Tuttavia, reagiscono (must have reacted) 2.84 x 10 -2 moli di CaCO3 La massa percentuale del campione di CaCO3 è: Assunto: le impurezze non reagiscono con HCl per produrre CO2 gassosa. 5.52 La reazione bilanciata è: In c.n., 1 mole di un gas ideale occupa un volume di 22.41 L. Possiamo utilizzare questo come fattore di conversione per calcolare le moli di H2 che reagiscono. Possiamo poi calcolare la massa di HCl prodotto. Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl ? moli di H2 che reagiscono = La massa di HCl prodotto è: 5.53 Possiamo calcolare le moli reagite di M, e le moli di H2 gassoso prodotto. Confrontando il numero di moli di M reagito e il numero di moli di H2 prodotto, possiamo determinare il rapporto molare nella reazione bilanciata. Punto 1: Per prima calcoliamo le moli del metallo (M) che reagiscono Punto 2: Calcoliamo algebricamente nH2 dall’equazione dei gas ideali. Calcoliamo, poi, le moli di H2 sostituendo nell’equazione le quantità note. Punto 3: Confrontiamo il numero di moli di H2 prodotto col numero di moli di M reagito Questo significa che il rapporto molare tra H2 e M è 1.5 : 1. Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl Punto 4: Conoscendo il rapporto molare tra H2 e M, possiamo scrivere la reazione bilanciata. La reazione non bilanciata è: Abbiamo 3 atomi di H dal lato dei prodotti di reazione, così si deve porre un 3 davanti ad HCl. Il rapporto tra M e Cl dal lato dei reagenti è ora 1 : 3. Tuttavia la formula del cloruro metallico deve essere MCl3. La reazione bilanciata è: Dalla formula del cloruro metallico, determiniamo che la carica del metallo è +3. Tuttavia, la formula dell’ossido metallico e del solfato metallico sono, rispettivamente, M2O3 e M2(SO4)3. 5.54 Se determini la massa molare del gas, sarai capace di determinare la formula molecolare dalla formula empirica. Per prima cosa, calcola la massa molare del composto. Calcolando la massa molare: Per calcolare la formula empirica, abbiamo innanzitutto bisogno di trovare la massa di F in 0.2631 g di CaF2 Poiché il composto contiene soltanto P e F, la massa di P in 0.2324 g del campione è: Ora, convertiamo le masse di P e F in moli di ogni sostanza Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl Così arriviamo alla formula P0.003371F0.006737. Dividendo per il numero più piccolo di moli (0.003371 moli) abbiamo la formula empirica PF2. Per determinare la formula molecolare, dividiamo la massa molare per la massa empirica massa molare / massa molare empirica = Quindi, la formula molecolare è (PF2)2 o P2F4. 5.57 Per prima cosa, calcoliamo la frazione molare di ogni componente nella miscela. Poi possiamo calcolare la pressione parziale di ogni componente usando l’equazione Pi = XiPT. Il numero di moli dei gas combinati è: Le pressioni parziali sono: 5.58 La legge di Dalton afferma che la pressione totale di una miscela è pari alla somma delle pressioni parziali (a) Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl (b) Noi conosciamo: Condizioni iniziali Condizioni finali Poiché n1 = n2, possiamo scrivere 5.59 Poiché il volume è proporzionale al numero di moli del gas presente, possiamo direttamente convertire il volume percentuale in frazioni molari. (a) Per ogni gas, Pi = XiPT = Xi (1.00 atm) (b) La concentrazione (mol/L) è c = n/V = P/RT. Dunque abbiamo: Allo stesso modo, Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl 5.60 In questo caso, 5.61 Se possiamo calcolare le moli di H2 raccolto, possiamo determinare la quantità di Na che ha reagito. Possiamo calcolare le moli di H2 gassoso usando l’equazione dei gas ideali. Il numero di moli di idrogeno gassoso raccolto è: La reazione bilanciata mostra un rapporto molare di 2:1 tra Na e H2. La massa di Na consumata nella reazione è: 5.62 Strategia: per calcolare le moli di H2 generato, dobbiamo prima calcolare la pressione parziale di H2 nella miscela. Di quale legge dei gas abbiamo bisogno? Come convertiamo le moli di H2 in quantità di Zn reagito? Soluzione: la legge delle pressioni parziali di Dalton afferma che In questo caso, Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl Ora che conosciamo la pressione di H2 gassoso, possiamo calcolare le moli di H2. Usando poi il rapporto molare dalla reazione bilanciata, possiamo calcolare le moli di Zn. Usando il rapporto molare dalla reazione bilanciata e la massa molare dello zinco, possiamo ora calcolare i grammi di zinco consumati nella reazione. 5.63 Nella miscela, la temperatura e il volume occupati sono gli stessi per i due gas, così la pressione sarà proporzionale al numero di moli. Ricordiamo che Pi = XiPT. La frazione molare dell’ossigeno è: In altre parole 4.8% di particelle gassose sono molecole di ossigeno, che occupa il 4.8% del volume. 5.64 Pi = XiPT Dobbiamo determinare la frazione molare di ogni componente per determinare le pressioni parziali. Per calcolare la frazione molare, scriviamo la reazione chimica bilanciata per determinare il rapporto molare corretto. Le frazioni molari di H2 e N2 sono: Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl Le pressioni parziali di H2 e N2 sono: 5.71 Come dovrebbe essere, UF6, il gas più pesante, ha una velocità media minore del gas più leggero, O2. 5.72 Strategia: per calcolare la velocità quadratica media, usiamo l’Equazione (5.16) del testo. Quale unità di misura useremo per R e M in modo tale che µrms sia espressa in m/s? Soluzione: Per calcolare µrms, l’unità di R dovrebbe essere 8.314 J/mol·K, e poiché 1 J = 1 kg·m2/s2, l’unità di misura della massa molare sarà kg/mol. Per prima cosa calcoliamo le masse molari (M) di N2, O2 e O3. Ricordiamo che M deve essere espressa in kg/mol. Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl Ora possiamo sostituire nell’Equazione (5.16) del testo. Allo stesso modo, Verifica: poiché le masse molari dei gas aumentano nell’ordine: N2 < O2 < O3, ci aspettiamo che il gas più leggero (N2) si muova in media più velocemente e il gas più pesante (O3) si muova più lentamente. Questo è confermato dai calcoli sovrastanti. 5.73 (a) Inversamente proporzionale alla densità (b) Indipendente dalla temperatura (c) Diminuisce all’aumentare della pressione (d) Aumenta all’aumentare del volume (e) Inversamente proporzionale alla dimensione Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl 5.74 Velocità rms = Velocità media = Il valore della velocità quadratica media è sempre maggiore del valore della velocità media, perchè la radice quadrata favorisce i valori maggiori contrariamente a quanto succede prendendo semplicemente il valore medio. 5.79 In questo problema, confrontiamo la pressione determinata dall’equazione di van der Waals con quella determinata con l’equazione dei gas ideali. Equazione di van der Waals: Troviamo la pressione risolvendo prima algebricamente rispetto a P. dove Equazione dei gas ideali: Poiché la pressione calcolata usando l’equazione di van der Waals è paragonabile alla pressione calcolata usando l’equazione dei gas ideali, concludiamo che CO2 si comporta abbastanza idealmente sotto queste condizioni. 5.80 Strategia: in questo problema possiamo determinare se il gas devia dal comportamento ideale, confrontando la pressione ideale con quella effettiva. Possiamo calcolare la pressione ideale del gas Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl usando l’equazione dei gas ideali, e paragonarla alla pressione effettiva data nel problema. Quale unità di misura useremo per la temperatura nel calcolo? Soluzione: convertiamo la temperatura in kelvin, poi sostituiamo le quantità date nell’equazione dei gas ideali. Ora, possiamo confrontare la pressione ideale alla pressione effettiva calcolando l’errore percentuale. Sulla base del grande errore percentuale, concludiamo che sotto queste condizioni di alta pressione, il gas si comporta in modo non ideale. 5.81 (a) Non cambia considerevolmente né la quantità del gas nel pneumatico né il suo volume. La pressione è proporzionale alla temperatura. Quindi, all’aumentare della temperatura, la pressione aumenta. (b) Appena la busta di carta viene colpita, il suo volume diminuisce e così la pressione aumenta. Il rumore dello scoppio avviene quando la busta si rompe. (c) Come il pallone prende quota, la pressione esterna diminuisce costantemente e il pallone si espande. (d) La pressione nella lampadina è maggiore di 1 atm. 5.82 Puoi progettare la seguente strategia per calcolare il volume totale del gas. grammi di nitroglicerina → moli di nitroglicerina → moli di prodotti → volume di prodotti Calcolando il volume dei prodotti: Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl La relazione tra la pressione parziale e Ptotale è: Calcoliamo la frazione molare di ogni componente gassoso, poi calcoliamo la sua pressione parziale usando la suddetta equazione Xcomponente = moli del componente / moli totali di tutti i componenti Allo stesso modo, Allo stesso modo, 5.83 Dobbiamo determinare la massa molare del gas. Confrontando la massa molare alla massa empirica potremo determinare la formula molecolare. La massa empirica di CH = 13.02 g/mol Poiché , la formula molecolare è (CH)6 o C6H6. Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl 5.84 (a) (b) Strategia: dal volume di N2, possiamo calcolare le moli di N2 usando l’equazione dei gas ideali. Dalla reazione bilanciata, vediamo che 1 mole di N2 ≅ 1 mole di NH4NO2. Una volta determinate le moli di NH4NO2, possiamo convertirle in grammi usando la massa molare come fattore di conversione. Soluzione: per prima cosa calcoliamo le moli di N2 usando l’equazione dei gas ideali. Poi calcoliamo la massa di NH4NO2 necessaria a produrre 4.27 x 10 -3 moli di N2. 5.85 La reazione è: La massa di HCO3- reagito è: 3.29 g di pastiglia moli di CO2 prodotte = . Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl 5.86 No, perché un gas ideale non può essere liquefatto, dal momento che in un gas ideale non ci sono forze intermolecolari. 5.87 (a) Il numero di moli di Ni(CO)4 formato è: . La pressione di Ni(CO)4 è: (b) Ni(CO)4 si decompone per produrre più moli di gas (CO), che aumenta la pressione. 5.88 La pressione parziale del diossido di carbonio è maggiore in inverno perché il diossido di carbonio è meno utilizzato nella fotosintesi delle piante. 5.89 Usando l’equazione dei gas ideali, possiamo calcolare le moli di gas. Poi, usiamo il numero di Avogadro per convertire a molecole di gas. 1.30 x 1022 molecole di gas I gas più comuni presenti nell’aria esalata sono: CO2, O2, e H2O. Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl 5.90 (a) Scriviamo una reazione chimica bilanciata Per prima, calcoliamo le moli di CO2 prodotte. Poi calcoliamo il volume di CO2 prodotto usando l’equazione dei gas ideali. (b) (c) La reazione chimica bilanciata per la decomposizione di NH4HCO3 è Il vantaggio nell’usare il sale di ammonio è che si produce più gas per grammo di reagente. Lo svantaggio è che uno dei gas è ammoniaca. Il forte odore dell’ammoniaca rende il sale di ammonio una cattiva scelta per la cottura. 5.91 Massa dell’atmosfera terrestre = (area superficiale della terra in cm2) x (massa per 1 cm2 di colonna) La massa di una singola colonna d’aria con un’area superficiale di 1 cm2 è: L’area superficiale della Terra in cm2 è: Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl 5.92 Per prima calcoliamo le moli di H2 formato Poi calcoliamo il volume di H2 prodotto usando l’equazione dei gas ideali. 5.93 Per calcolare la molarità di NaOH, abbiamo bisogno delle moli di NaOH e del volume della soluzione di NaOH. Il volume è dato nel problema; quindi dobbiamo calcolare le moli di NaOH. Le moli di NaOH possono essere calcolate dalla reazione di NaOH con HCl. La reazione bilanciata è: Si trova il numero di moli di HCl gassoso dall’equazione dei gas e Le moli di NaOH possono essere calcolate usando il rapporto molare dalla reazione bilanciata La molarità della soluzione di NaOH è: 5.94 (a) (b) Dalla reazione bilanciata, vediamo che c’è un rapporto molare di 1:3 tra C3H8 e CO2. ideali Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl 5.95 Quando l’acqua entra nel pallone dal contagocce, si scioglie un po’ di cloruro di idrogeno, creando un parziale vuoto. La pressione dall’atmosfera spinge più acqua su nel tubo verticale. 5.96 Calcoliamo il numero iniziale di moli di NO e O2 usando l’equazione dei gas ideali. Determiniamo qual è il reagente limitante. Il numero di moli di NO e O2 sopra calcolati sono uguali: tuttavia, la reazione bilanciata mostra che sono necessarie il doppio delle moli di NO rispetto a quelle di O2. Così NO è il reagente limitante. Determiniamo la quantità molare di NO, O2 e NO2 dopo la reazione completa. (tutto NO è consumato durante la reazione) mol O2 consumato = mol O2 restante = Calcoliamo le pressioni parziali di O2 e NO2 usando l’equazione dei gas ideali. Volume dell’intero apparato = Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl 5.97 La circonferenza del cilindro è (a) La velocità a cui si muove il bersaglio è uguale a: velocità del bersaglio = circonferenza x rivoluzioni / sec velocità del bersaglio = (b) (c) Gli atomi di Bi devono muoversi attraverso il cilindro per colpire il bersaglio. Questa distanza è il diametro del cilindro che è 15.0 cm. Gli atomi di Bi percorrono questa distanza in 4.58 x 10-4 s. Le grandezze delle velocità sono paragonabili, ma non identiche. Questo non è sorprendente perché 328 m/s è la velocità di un esatto atomo di Bi e µrms è il suo valore medio. 5.98 (a) (b) Per prima dobbiamo calcolare il numero di moli di CO2 consumate nella reazione. Possiamo farlo calcolando le moli iniziali di CO2 nel recipiente e confrontandole poi alle moli di CO2 che restano dopo la reazione. Iniziali: Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl Restanti: Così, la quantità di CO2 consumata nella reazione è: Poiché il rapporto molare tra CO2 ed i due reagenti (CaO e BaO) è 1:1, devono aver reagito 0.0376 moli della miscela. Possiamo scrivere: x = massa di CaO nella miscela, poi (4.88 – x) = massa di BaO nella miscela. Possiamo scrivere: = massa di CaO nella miscela massa di BaO nella miscela = La composizione percentuale in massa nella miscela è: 5.99 (a) (b) 1000 ppm significa che ci sono 1000 particelle di gas per 1000000 particelle di aria. La pressione del gas è direttamente proporzionale al numero di particelle del gas. Possiamo calcolare la pressione parziale di CO in atmosfere, assumendo che la pressione atmosferica sia 1 atm. 1000 particelle / 1000000 particelle x 1 atm = Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl Una pressione parziale di 1.0 x 10-3 atm di CO è letale. Il volume del garage (in L) è: Dalla parte (a) dell’esercizio, noi conosciamo la velocità di produzione di CO al minuto. In un minuto la pressione parziale di CO sarà: Quanti minuti saranno necessari affinché la pressione parziale di CO raggiunga il livello letale, 1.0 x 10-3 atm? 5.100 Il volume di un alveolo è: Il numero di moli di aria in un alveolo può essere calcolato usando l’equazione dei gas ideali. Poiché l’aria negli alveoli contiene il 14% di ossigeno, le moli di ossigeno in un alveolo sono uguali a: Convertendo a molecole di O2: = 1.7 x 1012 molecole di O2 Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl 5.101 Nel problema 5.91 si è trovato che la massa dell’atmosfera terrestre è 5.25 x 1018 kg. Assumendo che la massa molare dell’aria sia 29.0 g/mol, possiamo calcolare il numero di molecole nell’atmosfera. = 1.09 x 1044 molecole (a) (b) Per prima cosa calcoliamo le moli di aria esalata in ogni respiro. = 1.96 x 10 -2 mol aria / respiro Poi convertiamo a molecole di aria per respiro. 1.96 x 10 -2 mol aria / respiro x 6.022 x 1023 molecole d’aria / 1 mole di aria = 1.18 x 1022 molecole / respiro 1.18 x10 22 molecole 12respiri 60 min 365 giorni 24h x x x x 35 anni = 2.60 x 1030 (c) x 1respiro 1 min 1h 1giorno 1anno molecole (d) La frazione di molecole nell’atmosfera respirate da Mozart è: Oppure, Così, circa 1 molecola di aria ogni 4 x 1013 molecole fu respirata da Mozart In ogni singolo respiro contenente 1.18 x 1022 molecole, respireremo in media: (1.18 x 1022 molecole) x 1 molecola d’aria di Mozart / 4 x 103 molecole d’aria = 3 x 108 molecole che Mozart esalò. (e) Abbiamo fatto i seguenti assunti: 1. Completo mescolamento dell’aria nell’atmosfera. 2. Nessuna fuga di molecole nell’atmosfera esterna. 3. Nessun utilizzo delle molecole durante il metabolismo, la fissazione dell’azoto, etc.. Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl 5.102 Quando a e b sono pari a zero, l’equazione di van der Waals diventa semplicemente l’equazione dei gas ideali. In altri termini, un gas ideale presenta valori pari a zero per a e b dell’equazione di van der Waals. È quindi chiaro che i gas con i valori più piccoli di a e b si comporteranno in modo più simile ai gas ideali sotto specifiche condizioni di temperatura e pressione. Per quanto riguarda la scelta del problema, il gas con i valori minori di a e b è Ne (vedi Tabella 5.3 del testo). 5.103 Sappiamo che la velocità quadratica media (µrms) di un gas può essere calcolata come segue: La velocità di diffusione (r) sarà direttamente proporzionale alla velocità quadratica media. I gas che si muovono a velocità maggiori si diffonderanno più velocemente. Per due gas diversi possiamo scrivere le velocità di diffusione come segue: Dividendo r1 per r2 si ottiene: Cancellando 3RT dall’equazione: L’equazione ottenuta ha un senso? Assumiamo che il gas1 sia più leggero (ha la massa molare minore) del gas2. Dividendo la massa molare più grande (M2) per la massa molare più piccola (M1) Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl avremo un numero maggiore di 1. Questo indica che il gas più leggero si diffonderà ad una velocità maggiore in confronto al gas più pesante. 5.104 La reazione tra Zn e HCl è: Dalla quantità di H2 (g) prodotto, possiamo determinare la quantità di Zn reagito. Poi, usando la massa iniziale del campione, possiamo calcolare la massa percentuale di Zn nel campione. Poiché il rapporto molare tra H2 e Zn è 1:1, anche la quantità di Zn reagito è 0.0498 moli. Convertendo a grammi di Zn, troviamo: La massa percentuale di Zn in 6.11 g del campione è: massa percentuale di Zn = massa di Zn / massa del campione x 100% 5.105 La legge dei gas ideali può essere usata per calcolare le moli di vapor d’acqua per litro. Noi alla fine vogliamo calcolare la distanza tra le molecole. Quindi convertiamo le moli in molecole, e convertiamo i litri nell’unità di misura del volume che ci consentirà di calcolare la distanza (m3). Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl Questo è il numero delle molecole di gas ideale in un cubo con ogni lato di 1 m. Assumendo un’uguale distribuzione delle molecole lungo le tre direzioni reciprocamente perpendicolari definite dal cubo, si trova una densità lineare in una direzione: Questo è il numero di molecole su una linea di un metro di lunghezza. La distanza tra ogni molecola è data da: Assumendo che la molecola d’acqua sia una sfera con un diametro di 0.3 nm, le molecole d’acqua sono separate da più di 12 volte il loro diametro: Un calcolo simile è fatto per l’acqua liquida. Partendo con la densità, convertiamo a molecole per metro cubo. Questo è il numero di molecole d’acqua liquida in un metro cubo. Da questo punto, il calcolo è uguale a quello fatto per il vapor d’acqua, e lo spazio tra le molecole è calcolato usando la stessa assunzione. Assumendo che le molecole siano una sfera con un diametro di 0.3 nm, ad una cifra significativa, le molecole d’acqua si toccano l’un l’altra nella fase liquida. Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl 5.106 Quando il fusto è ammaccato, il volume diminuisce e quindi ci aspettiamo un aumento della pressione. Tuttavia, la pressione dovuta all’acetone vapore (400 mmHg) non cambierà molto se la temperatura resta a 18°C (la tensione di vapore è costante ad una data temperatura). All’aumentare della pressione, più acetone vapore si condenserà a liquido. Assumendo che l’aria non si sciolga nell’acetone, la pressione nel fusto aumenterà a causa dell’aumento della pressione dovuto all’aria. Inizialmente, la pressione totale è 750 mmHg. La pressione dovuta all’aria inizialmente è: Il volume iniziale del vapore nel fusto è: Quando il fusto è ammaccato, il volume occupato dal vapore diminuisce a: Lo stesso numero di molecole d’aria ora occupa un volume più piccolo. La pressione aumenta secondo la legge di Boyle. Questa è la pressione dovuta all’aria. La pressione dovuta all’acetone vapore è ancora 400 mmHg. La pressione totale nel fusto dopo l’incidente è: 5.107 Per prima cosa, calcoliamo le moli di idrogeno gassoso necessarie a riempire un giubbotto di salvataggio di 4.1 L. Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl La reazione bilanciata mostra un rapporto molare tra H2 e LiH di 1:1. Quindi sono necessarie 0.17 moli di LiH. Convertendo a massa in grammi: 5.108 La velocità di effusione è il numero di molecole che passano attraverso una barriera porosa in un determinato tempo. Maggiore è il tempo, minore è la velocità di effusione. Quindi l’Equazione (5.17) del testo può essere scritta come dove t1 e t2 sono, rispettivamente, i tempi di effusione dei gas 1 e 2. La massa molare di N2 è 28.02 g/mol. Scriviamo dove M è la massa molare del gas sconosciuto. Risolvendo per M, otteniamo Il gas è il diossido di carbonio, CO2 (massa molare = 44.01 g/mol). Durante la fermentazione del glucosio, sono prodotti etanolo e diossido di carbonio. 5.109 La velocità di effusione è il numero di molecole che passano attraverso una barriera porosa in un dato tempo. La massa molare di CH4 è 16.04 g/mol. Usando l’Equazione (5.17) del testo, troviamo la massa molare di Ni(CO)x. Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl Per trovare il valore di x, sottraiamo prima la massa molare di Ni da 174.7 g/mol. 116.0 g è la massa di CO in una mole di composto. La massa di 1 mole di CO è 28.01 g. Questo calcolo indica che ci sono 4 moli di CO in 1 mole del composto. Il valore di x è 4. 5.110 (a) No. La temperatura è un concetto statistico. (b) (i) Poiché i due campioni di He sono alla stessa temperatura, le loro velocità quadratiche medie e le energie cinetiche medie sono le stesse. (ii) Gli atomi di He in V1 (volume minore) collidono con le pareti più frequentemente. Poiché le energie cinetiche medie sono le stesse, la forza esercitata nelle collisioni è la stessa in entrambi i recipienti. (c) (i) La velocità quadratica media è maggiore alla temperatura più alta T2. (ii) Gli atomi di He alla temperatura più alta, T2, collidono con le pareti con una frequenza e con una forza maggiore. (d) (i) Falso. La velocità quadratica media è maggiore per il gas più leggero, He. (ii) Vero. I gas sono alla stessa temperatura. (iii) Vero. Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl 5.111 (a) L’abbassamento dei grafici è dovuto alle attrazioni intermolecolari tra le particelle dei gas. Consideriamo l’approccio di una singola molecola verso una parete del contenitore. Le attrazioni intermolecolari esercitate dalle particelle adiacenti tendono ad ammorbidire l’impatto provocato da questa molecola contro la parete. L’effetto totale è una pressione del gas inferiore a quella attesa per un gas ideale. Così PV/RT diminuisce. Il grafico aumenta a causa delle pressioni maggiori (volumi minori), le molecole sono l’una vicino all’altra e le forze repulsive tra di loro diventano dominanti. Le forze repulsive provocano un aumento della forza d’impatto delle molecole gassose con le pareti del contenitore. L’effetto totale è una pressione del gas maggiore di quella attesa per un gas ideale. Quindi, PV/RT > 1 e la curva aumenta sopra la linea orizzontale. (b) Per 1 mole di un gas ideale, PV/RT = 1, qualunque sia la pressione del gas. A pressioni molto basse, tutti i gas si comportano idealmente; tuttavia, PV/RT converge a 1 per pressioni prossime allo zero. Man mano che la pressione si avvicina allo zero, il comportamento del gas si avvicina sempre più a quello di una gas ideale. (c) L’intercetta sulla linea del gas ideale significa che PV/RT = 1. Tuttavia questo non significa che un gas si comporta idealmente. Significa soltanto che a questa particolare pressione l’attrazione molecolare è uguale alla repulsione molecolare così che l’interazione netta è zero. 5.112 (a) L’equazione per calcolare la velocità quadratica media è l’Equazione (5.16) del testo. Calcoliamo µpp e µrqm a 25°C (298 K). Ricordiamo che la massa molare di N2 deve essere espressa in kg/mol, perché l’unità di misura di R è J/mol·K e 1 J = 1 kg·m2/s2. La velocità più probabile (µpp) sarà sempre inferiore alla velocità quadratica media. Possiamo ricavare una relazione generale tra le due velocità. Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl Questa relazione indica che la velocità più probabile (µpp) sarà 81.6% della velocità quadratica media (µrqm) ad una data temperatura. (b) Possiamo ricavare una relazione tra le velocità più probabili a T1 e T2. Guardando il diagramma, assumiamo che la velocità più probabile a T1 = 300 K è 500 m/s, e la velocità più probabile a T2 è 1000 m/s. Sostituiamo nella suddetta equazione per calcolare T2. 5.113 Consideriamo il movimento di una singola molecola. A causa della gravità terrestre, l’aria è più densa vicino alla superficie. Una molecola “calda” ha un’energia cinetica maggiore e quindi una velocità maggiore. Colliderà con le molecole in tutte le direzioni. Tuttavia, poiché ci sono più molecole verso il basso, subisce più collisioni e perderà rapidamente la sua energia in eccesso. Poiché la densità dell’aria diminuisce con l’altezza, questa molecola si muoverà più lontano se si Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl muove verso l’alto. Ora, se partiamo con un ampio insieme di molecole calde, molte di esse si solleveranno notevolmente prima di dissipare la loro energia in eccesso. 5.114 (a) Vediamo dalla figura che due sfere rigide di raggio r non possono avvicinarsi l’una all’altra più di 2r (misurato dai centri delle sfere). Così, c’è una sfera di raggio 2r che circonda ogni sfera rigida da cui altre sfere rigide sono escluse. Il volume escluso / coppia di atomi è: Vescluso / coppia = Questo è pari ad otto volte il volume di un singolo atomo (b) Il risultato ottenuto in (a) è per una coppia di atomi, così il volume escluso / atomo è: Vescluso / atomo Per passare dal volume escluso per atomo al volume escluso per mole, dobbiamo moltiplicare per il numero di Avogadro, NA. Vescluso / mole = La somma dei volumi di una mole di atomi (trattati come sfere rigide di raggio r) è 4/3 NAπr3. Il volume escluso è quattro volte il volume delle sfere stesse. 5.115 Calcoliamo la pressione dell’ammoniaca usando sia l’equazione dei gas ideali che l’equazione di van der Waals. Possiamo poi calcolare l’errore percentuale ottenuto usando l’equazione dei gas ideali. Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl Gas ideale: Van der Waals: I valori di a e b usati sono quelli della Tabella 5.3 del testo. L’errore percentuale usando l’equazione dei gas ideali è: 5.116 Dalla velocità quadratica media, possiamo calcolare la massa molare dell’ossido gassoso. Il composto può essere un monossido perché 2 moli di ossigeno atomico hanno una massa di 32.00 g. La massa molare dell’altro elemento è: Il composto è il monossido di azoto, NO. 5.117 Partiamo con la legge di Graham, poiché questo problema si riferisce all’effusione dei gas. Usando la legge di Graham, possiamo calcolare la massa molare effettiva di una miscela di CO e CO2. Una volta nota la massa molare effettiva della miscela, possiamo determinare la frazione Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl molare di ogni componente. Poiché n ∝ V a T e P costanti, la percentuale in volume = frazione molare Ora che conosciamo la massa molare della miscela, possiamo calcolare la frazione molare di ogni componente e La frazione molare di ogni componente moltiplicato per la sua massa molare darà il contributo di quel componente alla massa molare effettiva. A P e T costanti, n ∝ V. Quindi la percentuale in volume = frazione molare, Come risultato, % CO in volume = 54.4 % % CO2 in volume = Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl 5.118 Pressione e volume sono costanti. Partiamo con l’Equazione (5.9) del testo. Poiché P1 = P2 e V1 = V2, questa equazione si riduce a: o Poiché T1 = 2T2, sostituendo nella suddetta equazione si avrà: o Questa equazione indica che il numero di moli di gas dopo della reazione è il doppio delle moli di gas prima della reazione. Soltanto la reazione (b) si adatta a questa descrizione. Fondamenti di chimica Raymond Chang Copyright © 2009 – The McGraw-Hill Companies srl
Scaricare